構造エピゲノム科学研究室
概要
生命現象にとって欠かせないタンパク質はいつも同じ形のまま止まっているわけではありません。他のタンパク質やDNA, RNAなどの核酸が相互作用したり、低分子化合物が化学結合すると形を変えることがあります。この形の変化がそのタンパク質の機能を切り替えたり情報を伝達したりします。また、形だけでなく、ダイナミクスと呼ばれる運動性が変わることもあります。私たちはさまざまな原核、真核生物のタンパク質のダイナミクスや構造の変化をNMRや質量分析を用いて解析しています。
スタッフ
教授 池上 貴久(いけがみ たかひさ)

<略歴>
大阪大学理学部生物学科卒業(1991)。(株)日立製作所那珂工場、奈良先端科学技術大学院大学・助手、博士号取得(大阪大学理学1999)、大阪大学蛋白質研究所・准教授を経て、2014年4月より横浜市立大学大学院教授。
<メッセージ>
核磁気共鳴(NMR)は強力な磁石と特有の電磁波を使って微弱な磁性をもつ原子核のスピンを操ったり観たりします。この核スピンの状態から、蛋白質の立体構造、ダイナミクス、相互作用の情報をつかむことができます。
大阪大学理学部生物学科卒業(1991)。(株)日立製作所那珂工場、奈良先端科学技術大学院大学・助手、博士号取得(大阪大学理学1999)、大阪大学蛋白質研究所・准教授を経て、2014年4月より横浜市立大学大学院教授。
<メッセージ>
核磁気共鳴(NMR)は強力な磁石と特有の電磁波を使って微弱な磁性をもつ原子核のスピンを操ったり観たりします。この核スピンの状態から、蛋白質の立体構造、ダイナミクス、相互作用の情報をつかむことができます。
准教授 明石 知子(あかし さとこ)

<略歴>
千葉大学薬学部卒業、薬学博士(1991年千葉大学)。味の素(株)中央研究所、理化学研究所を経て、2001年4月より横浜市立大学大学院総合理学研究科助教授、改組により2013年4月より同大大学院生命医科学研究科准教授。
<メッセージ>
タンパク質複合体において、「機能の変化」をもたらす分子の「形や運動性の変化」を、複合体を壊さずに、あるいは断片にしてから詳しく質量分析することで理解することを目指しています。
千葉大学薬学部卒業、薬学博士(1991年千葉大学)。味の素(株)中央研究所、理化学研究所を経て、2001年4月より横浜市立大学大学院総合理学研究科助教授、改組により2013年4月より同大大学院生命医科学研究科准教授。
<メッセージ>
タンパク質複合体において、「機能の変化」をもたらす分子の「形や運動性の変化」を、複合体を壊さずに、あるいは断片にしてから詳しく質量分析することで理解することを目指しています。
助教 長土居 有隆(ながどい ありたか)

<略歴>
1999年横浜市立大学大学院理学博士取得後、日本学術振興会特別研究員を経て、
2001年4月より横浜市立大学大学院総合理学研究科助手、改組のため2013年4月より同大大学院生命医科学研究科助教。
<メッセージ>
核磁気共鳴分光器(NMR)法を使って、蛋白質や核酸などの生体分子やそれに結合するリガンドの立体構造を解析し、それら相互作用から分かる生命活動の基礎を研究する。
1999年横浜市立大学大学院理学博士取得後、日本学術振興会特別研究員を経て、
2001年4月より横浜市立大学大学院総合理学研究科助手、改組のため2013年4月より同大大学院生命医科学研究科助教。
<メッセージ>
核磁気共鳴分光器(NMR)法を使って、蛋白質や核酸などの生体分子やそれに結合するリガンドの立体構造を解析し、それら相互作用から分かる生命活動の基礎を研究する。
研究内容
酵素によく見られるように蛋白質がその機能を発揮する際には、その立体構造やダイナミクスに変化が起こる場合が多いです。また、周りの溶媒の条件によって構造や安定性も変わります。そのような変化をおもに核磁気共鳴(NMR)や質量分析(MS)を使って解析しています。核磁気共鳴(NMR)を使うと、例えば蛋白質分子を作っている原子の中の核を観ることができます。具体的には原子核がNMRの磁石の中で回転する、正確には回転するとされている様子を検出します。この回転をスピンと呼びますが、これらスピンどうしの干渉や電磁波パルスを打ち込んだ時のスピンの影響を通して、スピンとスピンの間の距離やスピンの動きを知ることができます。
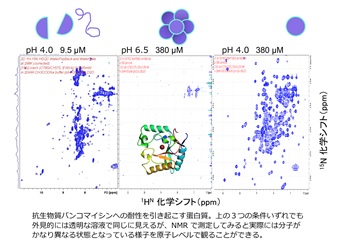
この性質を利用すると、蛋白質の立体構造、相互作用、ダイナミクスなどさまざまな性質を原子の分解能で得ることができます。蛋白質の中にはその機能の発現のオン・オフを切り替えるのにアロステリック効果と呼ばれる仕組みを利用している場合があります。このアロステリック効果にはあるリガンドが付いたり離れたりする際に蛋白質の構造やダイナミクスに大きな変化を引き起こすことがあり、その変化が遠くまで影響を及ぼします。この構造・ダイナミクスの変化には蛋白質の安定性が多いに関連することもあります。私たちは、そのような構造・ダイナミクス・安定性の変化をNMRを使って調べています。
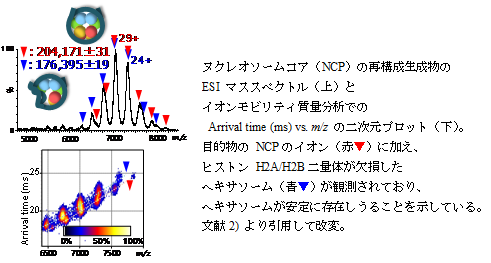
質量分析(MS)では、原理的には、分子量の上限なく微量試料で複合体丸ごとの質量測定が可能なので、他の物理化学的手法では確実に明らかにできないようなストイキオメトリーや解離・会合の様子等を観測することができます。また翻訳後修飾の位置も決定することができ、修飾と機能の変化について、構造から関連付けて考察することができます。このMSの特徴を活かして、真核生物の遺伝情報を核内にコンパクトに収納する最小構造単位であるヌクレオソームコアをはじめとする様々なタンパク質複合体について、修飾や他の分子との相互作用による機能と構造の変化を解析し理解する研究を行っています。
主要文献(Selected Publications)
Akashi, S., Maleknia, S., Saikusa, K., Downard, K.M. Stability of the βB2B3 Crystallin Heterodimer to Increased Oxidation by Radical Probe and Ion Mobility Mass Spectrometry. J. Struct. Biol., 189, 20-27 (2015).
Saikusa, K., Nagadoi, A., Hara, K., Fuchigami, S., Kurumizaka, H., Nishimura, Y., Akashi, S. Mass spectrometric approach for characterizing the disordered tail regions of the histone H2A/H2B dimer. Anal. Chem., 87, 2220-2227 (2015).
Tsuchida, D., Yamazaki, K, Akashi, S. Comprehensive Characterization of Relationship Between Higher-Order Structure and FcRn Binding Affinity of Stress-Exposed Monoclonal Antibodies. Pharm. Res., 33, 994-1002 (2016).
Noguchi, H., Ikegami, T., Nagadoi, A., Kamatari, Y.O., Park, S.Y., Tame, J.R., Unzai, S. The structure and conformational switching of Rap1B. Biochem. Biophys. Res. Commun., 462, 46-51 (2015).
Oktaviani, N.A., Risør, M.W., Lee, Y.H., Megens, R.P., de Jong, D.H., Otten, R., Scheek, R.M., Enghild, J.J., Nielsen, N.C., Ikegami, T., Mulder, F.A. Optimized co-solute paramagnetic relaxation enhancement for the rapid NMR analysis of a highly fibrillogenic peptide. J. Biomol. NMR, 62, 129-142 (2015).
Tanaka, H., Akagi, K., Oneyama, C., Tanaka, M., Sasaki, Y., Kanou, T., Lee, Y.H., Yokogawa, D., Dobenecker, M.W., Nakagawa, A., Okada, M., Ikegami, T. Identification of a new interaction mode between the Src homology 2 (SH2) domain of C-terminal Src kinase (Csk) and Csk-binding protein (Cbp)/phosphoprotein associated with glycosphingolipid microdomains (PAG). J. Biol. Chem., 288, 15240-15254 (2013).
Saikusa, K., Nagadoi, A., Hara, K., Fuchigami, S., Kurumizaka, H., Nishimura, Y., Akashi, S. Mass spectrometric approach for characterizing the disordered tail regions of the histone H2A/H2B dimer. Anal. Chem., 87, 2220-2227 (2015).
Tsuchida, D., Yamazaki, K, Akashi, S. Comprehensive Characterization of Relationship Between Higher-Order Structure and FcRn Binding Affinity of Stress-Exposed Monoclonal Antibodies. Pharm. Res., 33, 994-1002 (2016).
Noguchi, H., Ikegami, T., Nagadoi, A., Kamatari, Y.O., Park, S.Y., Tame, J.R., Unzai, S. The structure and conformational switching of Rap1B. Biochem. Biophys. Res. Commun., 462, 46-51 (2015).
Oktaviani, N.A., Risør, M.W., Lee, Y.H., Megens, R.P., de Jong, D.H., Otten, R., Scheek, R.M., Enghild, J.J., Nielsen, N.C., Ikegami, T., Mulder, F.A. Optimized co-solute paramagnetic relaxation enhancement for the rapid NMR analysis of a highly fibrillogenic peptide. J. Biomol. NMR, 62, 129-142 (2015).
Tanaka, H., Akagi, K., Oneyama, C., Tanaka, M., Sasaki, Y., Kanou, T., Lee, Y.H., Yokogawa, D., Dobenecker, M.W., Nakagawa, A., Okada, M., Ikegami, T. Identification of a new interaction mode between the Src homology 2 (SH2) domain of C-terminal Src kinase (Csk) and Csk-binding protein (Cbp)/phosphoprotein associated with glycosphingolipid microdomains (PAG). J. Biol. Chem., 288, 15240-15254 (2013).
 生命医科学研究科
生命医科学研究科