分子細胞医科学研究室
概要
生物は、ゲノムに蓄えられた遺伝情報を状況に応じて適切に利用する仕組みを備えており、この仕組みは、様々な生命活動を円滑に進めるために必要な分子基盤となっています。また生物は、自ら生み出したエネルギーを利用して、自然界の流れに逆らって様々な「秩序」を自己組織化します。この「秩序」の精緻さは驚くべきものであり、その乱れは様々な疾病の原因となります。分子細胞医科学研究室では、遺伝情報の発現の仕組みと細胞の秩序だった振る舞いを支える仕組みを様々な観点(分子・細胞・個体レベル)から研究することにより、生物をより深く理解し、生命医科学の発展に寄与することを目指しています。
スタッフ
教授 古久保 哲朗(こくぼ てつろう)

<略歴>
東京大学大学院農学系研究科博士課程修了(1990年)。農学博士。米国NIH研究員(1990-1995年)、奈良先端科学技術大学院大学助教授(1995-2001年)を経て現職。
<メッセージ>
DNAに保存された遺伝情報を読み取る(転写する)ためには、転写装置が情報の始まる場所を正確に認識する必要があります。ヒトから酵母までその仕組みはほぼ同じと考えられていますが、実体はまだよく分かっていません。私たちは転写の基本的な仕組みの解明を目指して研究に取り組んでいます。
東京大学大学院農学系研究科博士課程修了(1990年)。農学博士。米国NIH研究員(1990-1995年)、奈良先端科学技術大学院大学助教授(1995-2001年)を経て現職。
<メッセージ>
DNAに保存された遺伝情報を読み取る(転写する)ためには、転写装置が情報の始まる場所を正確に認識する必要があります。ヒトから酵母までその仕組みはほぼ同じと考えられていますが、実体はまだよく分かっていません。私たちは転写の基本的な仕組みの解明を目指して研究に取り組んでいます。
准教授 鈴木 厚(すずき あつし)

<略歴>
京都大学大学院理学研究科博士課程修了(1991年)。理学博士。国立精神神経センター・神経研究所 研究員(1991年-1994年)、横浜市立大学大学院医学研究科 助手、講師、准教授を経て、現職。
<メッセージ>
私達の多細胞生物の身体は、独特な形態と機能を示す多様な細胞が協調することで維持されています。共通な遺伝子を持った細胞がいかにして固有の非対称な形態・機能を獲得するのか、この点の解明が生命の謎を解く鍵の一つです。私達は、この鍵の一つとなるタンパク質を同定し、研究を進めています。
京都大学大学院理学研究科博士課程修了(1991年)。理学博士。国立精神神経センター・神経研究所 研究員(1991年-1994年)、横浜市立大学大学院医学研究科 助手、講師、准教授を経て、現職。
<メッセージ>
私達の多細胞生物の身体は、独特な形態と機能を示す多様な細胞が協調することで維持されています。共通な遺伝子を持った細胞がいかにして固有の非対称な形態・機能を獲得するのか、この点の解明が生命の謎を解く鍵の一つです。私達は、この鍵の一つとなるタンパク質を同定し、研究を進めています。
助教 高井 直樹(たかい なおき)

<略歴>
名古屋大学大学院・理学研究科博士後期課程修了(2007年)。博士(理学)。日本学術振興会特別研究員PD(名古屋大学大学院・生命農学研究科)、CREST研究員(名古屋大学大学院・理学研究科)を経て2011年9月より現職。
<メッセージ>
自分が面白いと思えることを学生のみなさんに伝えられるように心がけます。また、基本的な生物学的手法は必要ですが、生物、物理、化学の枠にとらわれず、どん欲に新しい手技手法、知見を吸収するようなスタンスがこれからのサイエンスには必要とされます。
名古屋大学大学院・理学研究科博士後期課程修了(2007年)。博士(理学)。日本学術振興会特別研究員PD(名古屋大学大学院・生命農学研究科)、CREST研究員(名古屋大学大学院・理学研究科)を経て2011年9月より現職。
<メッセージ>
自分が面白いと思えることを学生のみなさんに伝えられるように心がけます。また、基本的な生物学的手法は必要ですが、生物、物理、化学の枠にとらわれず、どん欲に新しい手技手法、知見を吸収するようなスタンスがこれからのサイエンスには必要とされます。
研究内容
1. 古久保・高井グループ
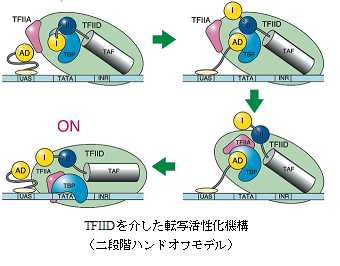
転写制御の分子機構を理解することは、発生・分化・形態形成など様々な生命現象を解き明かす上で非常に重要です。転写調節因子は、タンパク質間相互作用を介して転写開始点上に形成される基本転写装置の数あるいはその活性を制御し、各遺伝子の発現量を規定しています。一方、標的となる基本転写装置は、多数の基本転写因子(TFIIA, B, D, E, F, H)とRNAポリメラーゼ II から構成され、遺伝子の種類を問わず普遍的に機能します。基本転写因子のなかでもコアプロモーター構造を認識するTFIIDは、転写開始前複合体のアッセンブリーに際して核となる分子であり、転写調節因子から受け取った信号を転写量の増減へと変換するうえで中心的な役割を果たしています。我々は遺伝学、生化学的な手法を利用できる酵母を主な生物材料に用いて、TFIIDサブユニット(TAFs)の未知の機能を明らかにしていくことにより、TFIIDによるコアプロモーターの認識ならびに転写制御機構の分子的基盤を理解することを目指しています。
転写制御の分子機構を理解することは、発生・分化・形態形成など様々な生命現象を解き明かす上で非常に重要です。転写調節因子は、タンパク質間相互作用を介して転写開始点上に形成される基本転写装置の数あるいはその活性を制御し、各遺伝子の発現量を規定しています。一方、標的となる基本転写装置は、多数の基本転写因子(TFIIA, B, D, E, F, H)とRNAポリメラーゼ II から構成され、遺伝子の種類を問わず普遍的に機能します。基本転写因子のなかでもコアプロモーター構造を認識するTFIIDは、転写開始前複合体のアッセンブリーに際して核となる分子であり、転写調節因子から受け取った信号を転写量の増減へと変換するうえで中心的な役割を果たしています。我々は遺伝学、生化学的な手法を利用できる酵母を主な生物材料に用いて、TFIIDサブユニット(TAFs)の未知の機能を明らかにしていくことにより、TFIIDによるコアプロモーターの認識ならびに転写制御機構の分子的基盤を理解することを目指しています。
2. 鈴木グループ
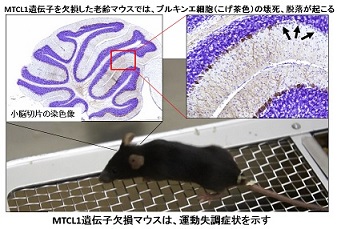
私達の身体の中のさまざまな細胞がそれぞれに固有の形態や機能(個々の細胞の「非対称性、極性」)を発達させることは、「一個の受精卵から多細胞生物が作り出される過程」にも、また、「成熟した生体の生理機能の維持」にも非常に重要です。そして、この「細胞極性」の発達は「微小管と呼ばれる細胞骨格線維を細胞内でいかに配向させるか」ということによって決定的に制御されています。私達は近年、この微小管の配向や安定性に決定的に関わる全く新しい微小管架橋因子、MTCL1 (Microtubule crosslinking factor 1)を発見し、この分子が私たちの身体を覆う上皮細胞や神経細胞の極性の形成に非常に重要な働きをしていることを明らかにしました。また、遺伝子改変マウスの研究などを通じて、この分子の欠失がヒトの神経疾患の原因になっている可能性も明らかにしつつあります。近年、中心体から伸びていない「非中心体性微小管」の重要性が注目されていますが、本タンパク質の研究はこうした研究を進める上でも大きな鍵となっていくことが予想されています。
私達の身体の中のさまざまな細胞がそれぞれに固有の形態や機能(個々の細胞の「非対称性、極性」)を発達させることは、「一個の受精卵から多細胞生物が作り出される過程」にも、また、「成熟した生体の生理機能の維持」にも非常に重要です。そして、この「細胞極性」の発達は「微小管と呼ばれる細胞骨格線維を細胞内でいかに配向させるか」ということによって決定的に制御されています。私達は近年、この微小管の配向や安定性に決定的に関わる全く新しい微小管架橋因子、MTCL1 (Microtubule crosslinking factor 1)を発見し、この分子が私たちの身体を覆う上皮細胞や神経細胞の極性の形成に非常に重要な働きをしていることを明らかにしました。また、遺伝子改変マウスの研究などを通じて、この分子の欠失がヒトの神経疾患の原因になっている可能性も明らかにしつつあります。近年、中心体から伸びていない「非中心体性微小管」の重要性が注目されていますが、本タンパク質の研究はこうした研究を進める上でも大きな鍵となっていくことが予想されています。
主要文献(Selected Publications)
*K. Maeshima, K. Kaizu, S. Tamura, T. Nozaki, T. Kokubo, K. Takahashi. The physical size of transcription factors is key to transcriptional regulation in chromatin domains. J Phys Condens Matter., vol.27, No.6, 064116 (2015)
K. Watanabe, M. Yabe, K. Kasahara, *T. Kokubo. A random screen using a novel reporter assay system reveals a set of sequences that are preferred as the TATA or TATA-like elements in the CYC1 promoter of Saccharomyces cerevisiae. PLoS One. vol.10, No.6, e0129357 (2015)
Y. Sato, K Hayashi, Y. Amano, M. Takahashi S. Yonemura, I. Hayashi, H. Hirose, S Ohno, *A. Suzuki. MTCL1 crosslinks and stabilizes noncentrosomal microtubules on the Golgi membrane. Nat. Communi. 5: 5266-80 (2014)
Y. Sato, M. Akitsu, Y. Amano, K. Yamashita, M. Ide, K. Shimada, A. Yamashita, H. Hirano, N. Arakawa, T. Maki, I. Hayashi, S. Ohno, *A. Suzuki. A novel PAR-1-binding protein, MTCL1, plays critical roles in organizing microtubules in polarizing epithelial cells. J. Cell Sci., vol.126: 4671-4683 (2013)
*M. Hanaoka, N. Takai, N. Hosokawa, M. Fujiwara, Y. Akimoto, N. Kobori, H. Iwasaki, T. Kondo, K. Tanaka RpaB, another response regulator operating circadian clock-dependent transcriptional regulation in Synechococcus elongatus PCC 7942. J Biol Chem. vol.287, No.31, 26321-26327 (2012)
K. Watanabe, M. Yabe, K. Kasahara, *T. Kokubo. A random screen using a novel reporter assay system reveals a set of sequences that are preferred as the TATA or TATA-like elements in the CYC1 promoter of Saccharomyces cerevisiae. PLoS One. vol.10, No.6, e0129357 (2015)
Y. Sato, K Hayashi, Y. Amano, M. Takahashi S. Yonemura, I. Hayashi, H. Hirose, S Ohno, *A. Suzuki. MTCL1 crosslinks and stabilizes noncentrosomal microtubules on the Golgi membrane. Nat. Communi. 5: 5266-80 (2014)
Y. Sato, M. Akitsu, Y. Amano, K. Yamashita, M. Ide, K. Shimada, A. Yamashita, H. Hirano, N. Arakawa, T. Maki, I. Hayashi, S. Ohno, *A. Suzuki. A novel PAR-1-binding protein, MTCL1, plays critical roles in organizing microtubules in polarizing epithelial cells. J. Cell Sci., vol.126: 4671-4683 (2013)
*M. Hanaoka, N. Takai, N. Hosokawa, M. Fujiwara, Y. Akimoto, N. Kobori, H. Iwasaki, T. Kondo, K. Tanaka RpaB, another response regulator operating circadian clock-dependent transcriptional regulation in Synechococcus elongatus PCC 7942. J Biol Chem. vol.287, No.31, 26321-26327 (2012)
 生命医科学研究科
生命医科学研究科