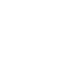構造細胞科学研究室
概要
細胞内の詳細構造やその機能を支えるタンパク質の構造・物性・機能を主に物理化学的手法を元に解析しています。アクチンは細胞内において多様で重要な機能をはたしており、様々な疾患とも関連していますが、我々はアクチン繊維の多機能性には繊維の協同的な構造多型性が関連することを提唱し、独自な視点から研究しています。またタンパク質構造解析技術の一つとして電子顕微鏡構造解析に着目し、膜タンパク質や複雑な構造をもつ複合体構造の構造解析を通じて構造-機能連関の探求や疾病の原因解明を目指しています。
スタッフ
大学院客員教授 富井 健太郎(とみい けんたろう)

<略歴>
京都大学大学院理学研究科生物科学専攻博士後期課程修了、博士(理学)(1998年)、株式会社生物分子工学研究所ポストドクトラルフェロー、UC Berkeleyポストドクトラルフェローを経て、2001年4月より産業技術総合研究所研究員(現在に至る)、2016年4月より横浜市立大学大学院客員教授。
<メッセージ>
科学技術の発展に伴い、本格的な計算生物学の時代の幕開けが到来している今、これまでにない新たな生物学研究を創造する絶好の機会です。夢中になれる研究を見つけましょう。
京都大学大学院理学研究科生物科学専攻博士後期課程修了、博士(理学)(1998年)、株式会社生物分子工学研究所ポストドクトラルフェロー、UC Berkeleyポストドクトラルフェローを経て、2001年4月より産業技術総合研究所研究員(現在に至る)、2016年4月より横浜市立大学大学院客員教授。
<メッセージ>
科学技術の発展に伴い、本格的な計算生物学の時代の幕開けが到来している今、これまでにない新たな生物学研究を創造する絶好の機会です。夢中になれる研究を見つけましょう。
大学院客員准教授 三尾和弘(みお かずひろ)

<略歴>
東北大学大学院理学研究科動物発生学博士前期修了(1990年)、博士(理学)(2002年)。ライオン株式会社研究員、UCSF訪問研究員を経て2009年4月より産業技術総合研究所主任研究員、2013年4月より横浜市立大学大学院客員准教授。
<メッセージ>
タンパク質の構造を解析する方法はいくつかありますが、電子顕微鏡は唯一『目で見える』という特徴があります。何が正しいかを五感とロジックをフルに使って解析していきたいと思っています。
東北大学大学院理学研究科動物発生学博士前期修了(1990年)、博士(理学)(2002年)。ライオン株式会社研究員、UCSF訪問研究員を経て2009年4月より産業技術総合研究所主任研究員、2013年4月より横浜市立大学大学院客員准教授。
<メッセージ>
タンパク質の構造を解析する方法はいくつかありますが、電子顕微鏡は唯一『目で見える』という特徴があります。何が正しいかを五感とロジックをフルに使って解析していきたいと思っています。
研究内容
アクチンは細胞内において多様で重要な機能をはたしており、様々な疾患とも関連している。そうした多機能性は、アクチンフィラメントが多様なアクチン結合タンパク質と適切に相互作用するためであると考えられている。それでは、それぞれのアクチンフィラメントはどのようにして、細胞内にある多様なアクチン結合タンパク質のなかから適切なものとのみ正しく相互作用するのだろうか。われわれは、アクチンフィラメントの多機能性にはフィラメントの協同的な構造多型性が関連することを提唱し、分子生物学と構造生物学を融合したアプローチで研究を進めている。
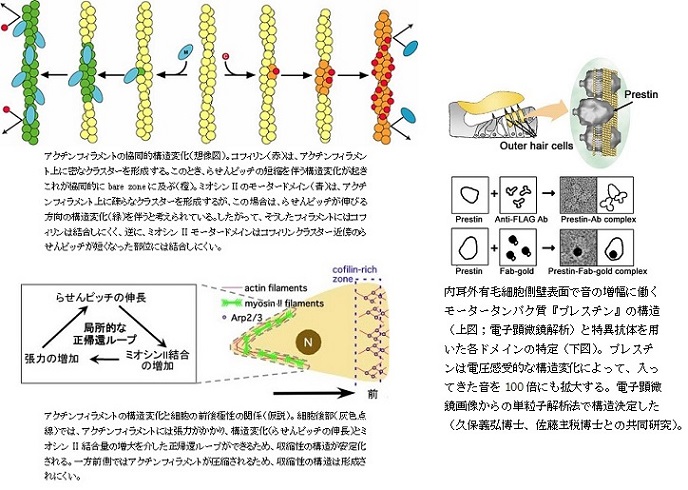
またタンパク質の機能理解や効率的な新薬シーズの開発には構造情報が不可欠である。様々な構造解析手法が知られる中で、膜タンパク質などの難結晶性試料や複雑な構造を持つ高分子複合体などの解析には電子顕微鏡が適している。撮像した膨大な数の電子顕微鏡画像から情報学的解析を繰り返して元の立体構造を導き出す単粒子解析法などの技術を使って、イオンチャネルやトランスポーターなどの構造・機能解析を進めている。また核膜内面に局在する核ラミナとその変異によって発症するラミン病(ラミノパチー)の発症機構に関する研究を電子顕微鏡、結晶解析、NMR解析などの構造学的手法、生化学、分子生物学、生物物理学等様々な手法を組み合わせて行っている。
またタンパク質の機能理解や効率的な新薬シーズの開発には構造情報が不可欠である。様々な構造解析手法が知られる中で、膜タンパク質などの難結晶性試料や複雑な構造を持つ高分子複合体などの解析には電子顕微鏡が適している。撮像した膨大な数の電子顕微鏡画像から情報学的解析を繰り返して元の立体構造を導き出す単粒子解析法などの技術を使って、イオンチャネルやトランスポーターなどの構造・機能解析を進めている。また核膜内面に局在する核ラミナとその変異によって発症するラミン病(ラミノパチー)の発症機構に関する研究を電子顕微鏡、結晶解析、NMR解析などの構造学的手法、生化学、分子生物学、生物物理学等様々な手法を組み合わせて行っている。
主要文献(Selected Publications)
Tokunaga F, Nishimasu H, Ishitani R, Goto E, Noguchi T, Mio K, Kamei K, Ma A, Iwai K, Nureki O (2012). Specific recognition of linear polyubiquitin by A20 zinc finger 7 is involved in NF-κB regulation. EMBO J. 31: 3856-3870.
Mio K, Mio M, Arisaka F, Sato M, Sato C (2010). The C-terminal coiled-coil of the bacterial voltage-gated sodium channel NaChBac is not essential for tetramer formation, but stabilizes subunit-to-subunit interactions. Prog. Biophys. Mol. Biol. 103: 111-121
Shiota, T., Imai, K., Qiu, J., Hewitt, V.L., Tan, K., Shen, H.H., Sakiyama, N., Fukasawa, Y., Hayat, S., Kamiya, M., Elofsson, A., Tomii, K., Horton, P., Wiedemann, N., Pfanner, N., Lithgow, T., Endo, T. (2015). Molecular architecture of the active mitochondrial protein gate. Science, 349(6255): 1544-1548.
Ito, J., Ikeda, K., Yamada, K., Mizuguchi, K., Tomii, K. (2015). PoSSuM v.2.0: data update and a new function for investigating ligand analogs and target proteins of small-molecule drugs. Nucleic Acids Res., 43: D392-D398.
Yamada, K., Tomii, K. (2014). Revisiting amino acid substitution matrices for identifying distantly related proteins. Bioinformatics, 30: 317-325.
Mio K, Mio M, Arisaka F, Sato M, Sato C (2010). The C-terminal coiled-coil of the bacterial voltage-gated sodium channel NaChBac is not essential for tetramer formation, but stabilizes subunit-to-subunit interactions. Prog. Biophys. Mol. Biol. 103: 111-121
Shiota, T., Imai, K., Qiu, J., Hewitt, V.L., Tan, K., Shen, H.H., Sakiyama, N., Fukasawa, Y., Hayat, S., Kamiya, M., Elofsson, A., Tomii, K., Horton, P., Wiedemann, N., Pfanner, N., Lithgow, T., Endo, T. (2015). Molecular architecture of the active mitochondrial protein gate. Science, 349(6255): 1544-1548.
Ito, J., Ikeda, K., Yamada, K., Mizuguchi, K., Tomii, K. (2015). PoSSuM v.2.0: data update and a new function for investigating ligand analogs and target proteins of small-molecule drugs. Nucleic Acids Res., 43: D392-D398.
Yamada, K., Tomii, K. (2014). Revisiting amino acid substitution matrices for identifying distantly related proteins. Bioinformatics, 30: 317-325.
 生命医科学研究科
生命医科学研究科