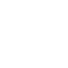創薬分子科学研究室
概要
様々な疾患の新たな創薬ターゲットの同定や生命現象を制御する新たな分子メカニズムを解明するために、数千人~数万人の大規模なゲノム解析を行っております。また、ケミカルバイオテクノロジーの開発により、新たな創薬候補となる生物活性化合物・人工タンパク質の創出に取り組んでいます。
スタッフ
大学院客員教授 桃沢 幸秀(ももざわ ゆきひで) ResearchMap →

<略歴>
東京大学大学院農学生命科学研究科修了(2007年) 博士(獣医学)。同年よりベルギー国リエージュ大学で博士研究員。その間、日本学術振興会の特別研究員・海外特別研究員。 2012年より現所属の理化学研究所・生命医科学研究センター・基盤技術開発研究チームに研究員として参加し、2015年よりチームリーダー。2018年から横浜市立大学大学院 生命医科学研究科 大学院客員教授。
<メッセージ>
ヒトのゲノムDNAの配列には個人間で少しずつ違いがありますが、それにより病気のなりやすさや薬の効果・副作用の個人差が生まれます。その関係から、病気の発症メカニズムを明らかにしたり、新しい創薬のターゲットを見つけるなど、我々人間は多くのことを学べると考えています。
大学院客員准教授 和田 章(わだ あきら) ResearchMap →

<略歴>
名古屋工業大学大学院 博士後期課程修了 (2001年) 工学博士。1999年から日本学術振興会 特別研究員(DC・PD)、産業技術総合研究所 特別研究員、理化学研究所 中央研究所 研究員、科学技術振興機構 さきがけ研究者、理化学研究所 基幹研究所 専任研究員を経て、2013年から横浜市立大学大学院 生命医科学研究科 大学院客員准教授。2018年から理化学研究所 生命機能科学研究センター 専任研究員。
名古屋工業大学大学院 博士後期課程修了 (2001年) 工学博士。1999年から日本学術振興会 特別研究員(DC・PD)、産業技術総合研究所 特別研究員、理化学研究所 中央研究所 研究員、科学技術振興機構 さきがけ研究者、理化学研究所 基幹研究所 専任研究員を経て、2013年から横浜市立大学大学院 生命医科学研究科 大学院客員准教授。2018年から理化学研究所 生命機能科学研究センター 専任研究員。
<メッセージ>
本研究室は、ケミカルバイオロジーとケミカルバイオテクノロジーを融合することで、各種疾患に関連した異常な生命現象にアプローチする低分子化合物や人工タンパク質を創出し、新たな創薬候補のタネを見出したいと考えています。
研究内容
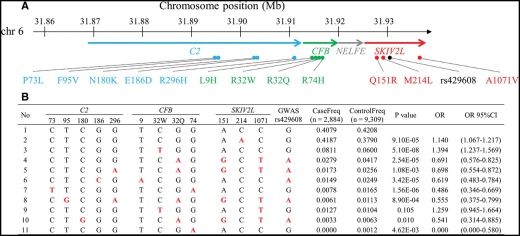 図1. 1万人以上の解析により明らかになった加齢黄斑変性とレアバリアントの関連 (Hum Mol Genet 25:5027-5034から引用)
図1. 1万人以上の解析により明らかになった加齢黄斑変性とレアバリアントの関連 (Hum Mol Genet 25:5027-5034から引用)
桃沢 幸秀
ヒトのゲノムDNAの配列は各個人により少しずつ異なり、それにより病気のなりやすさや薬の効果・副作用の個人差が生まれます。その関係を、数千人・数万人といった大規模なゲノム解析で明らかにすることで、これまでの研究では明らかにできなかった疾患の発症メカニズムや新たな治療・創薬のターゲットを明らかにすることができます。そのような大規模なゲノム解析を行うために、当研究室では、ウェット・ドライ解析の両方を組み合わせた新しいゲノム解析手法の構築を行うと共に、それを様々な疾患のサンプルについて適用して解析を行っています。
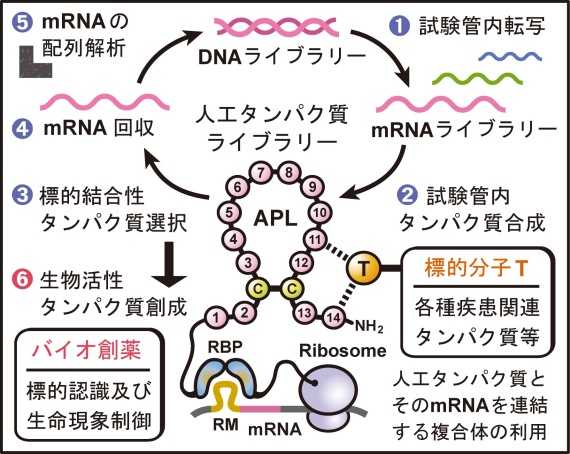 図2. 試験管内人工進化技術
図2. 試験管内人工進化技術
和田 章
生命現象の構成単位である“タンパク質”の生命機能をピンポイントに誘導もしくは抑制する特殊分子は、将来の医薬品候補となる可能性を秘めています。当研究室では、がんや感染症の原因である生命現象を特異的に制御する生物活性化合物を探索すると共に、その化合物の作用機序を解析する「ケミカルバイオロジー」に取り組んでいます。また、生命分子の誕生と進化を再現した試験管内人工進化技術(図2)を独自に開発することで、生物活性を獲得した人工タンパク質を創成する「ケミカルバイオテクノロジー」を推進し、バイオ創薬研究の新展開を目指しています。
主要文献(Selected Publications)
‣ Y. Momozawa, M. Akiyama, Y. Kamatani et al. Low-frequency coding variants in CETP and CFB are associated with susceptibility of exudative age-related macular degeneration in the Japanese population. Hum Mol Genet, 25, 5027–5034 (2016)
‣ Y. Momozawa, M. Mni, K. Nakamura et al. Resequencing of positional candidates identifies low frequency IL23R coding variants protecting against inflammatory bowel Ddsease. Nat Genet 43, 43-47 (2010)
‣ A.Wada, Ribosome display technology for selecting peptide and protein ligands., Biomedical Applications of Functionalized Nanomaterials, Elsevier, P89 (2018).
‣ M. Kawatani, M. Muroi, A. Wada, G. Inoue, Y. Futamura, H. Aono, K. Shimizu, T. Shimizu,Y. Igarashi, N. Takahashi-Ando, H. Osada, Proteomic profiling reveals that collismycin A is an iron chelator., Sci. Rep., 6, 38385 (2016).
‣ A. Wada, S. Hara, H. Osada, Ribosome display and photo-cross-linking techniques for in vitro identification of target proteins of bioactive small molecules., Anal. Chem., 86, 6768 (2014).
‣ A. Wada, K. Jitsukawa, H. Masuda, Superoxide disproportionations driven by zinc complexes with various steric and electrostatic properties., Angew. Chem. Int. Ed., 52, 12293 (2013)