研究内容
研究目的
構造生物学は生体分子 (タンパク質やDNA、またはその複合体) の“かたち = 立体構造” に基づいて生命現象を理解する研究領域です。私たちの研究室では、X線結晶構造解析、クライオ電子顕微鏡単粒子解析、X線溶液散乱法、高速原子間力顕微鏡などのさまざまな構造生物学的な研究手法を駆使して生命現象の解明を行っています。当研究室では、生体分子の立体構造に基づいて、細胞運命 (DNAメチル化やヒストン修飾などのエピジェネティクス) の決定とその運命が継承される仕組みの基本原理を理解し、その破綻によって生じる病気の薬剤の開発を目指しています。
⇒研究室紹介ポスターはこちら
細胞運命とは?
精子と卵子が受精してできた受精卵は、細胞分裂を繰り返します。細胞の数が約100個になると胚盤胞が形成され、これを形成する内部細胞塊は分化多能性を獲得します。その後細胞は運命に従って専門の働きを持つ細胞へと分化します。一旦分化した細胞はその運命を変えることなく、専門の細胞を生み出し続けます (始原生殖細胞を除く)。つまり細胞は運命に従ってその働きが決められ、その働きは個体の生涯にわたって維持されることになります (皮膚が神経細胞になったり、肝細胞が角膜になると困りますよね?)。この運命が正確に維持されないとがんなど様々な病気の原因となることが知られています。
細胞運命を制御するエピジェネティクス
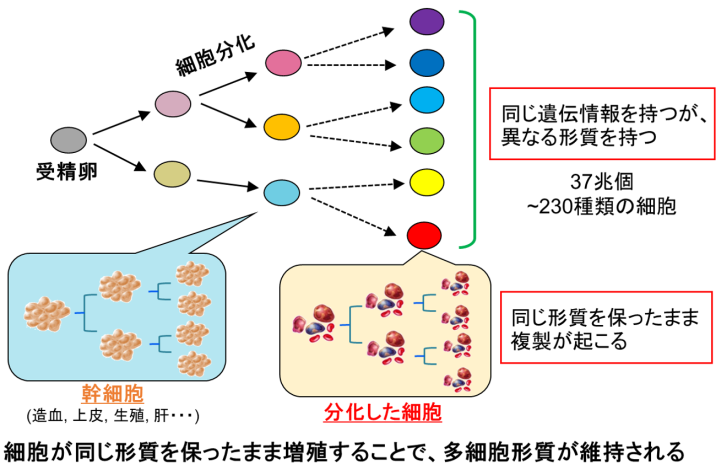
ヒト成人は約37兆個の細胞から成り、その種類は約230以上あります。これらの細胞はたった1個の受精卵に起因するので、我々の身体を構成する全ての細胞は同じ遺伝情報 (ゲノム = 塩基配列) を持ちます。同じ遺伝情報を持つにも関わらず、細胞が多種多様な形や働き (形質) を持てるのはなぜでしょうか?
それは分化した細胞で使われる遺伝子が制御されているからです。遺伝子の使い方を制御するのがDNAメチル化やヒストン修飾などのエピジェネティクスです。
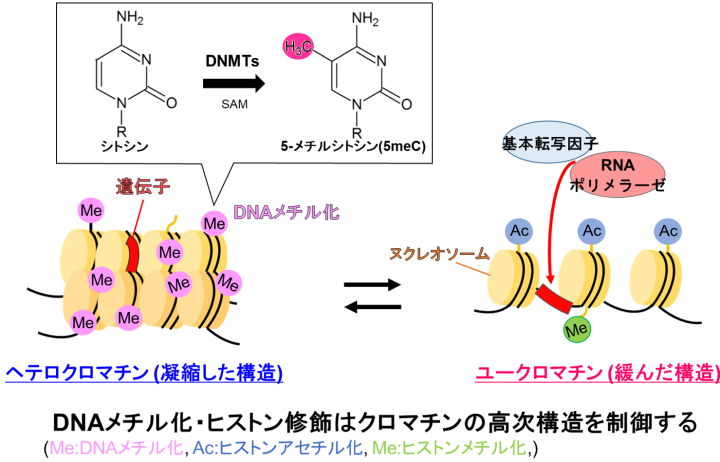
真核生物のDNAはヒストンタンパク質 (H2A, H2B, H3, H4からなる8量体:ヒストンオクタマー) に巻き付きヌクレオソーム構造をとります。ヌクレオソーム構造が基本単位となり高次クロマチン構造が形成されます。クロマチン構造は凝縮し遺伝子発現が不活性なヘテロクロマチンと、弛緩し遺伝子発現が活発なユークロマチンがあります。エピジェネティクスはこのクロマチン構造を制御し、細胞固有の遺伝子発現パターンを決めます。つまり、エピジェネティクスは同じゲノムを持つ細胞が多様な形質を生み出すために各細胞で使う/使わない遺伝子を決定するメカニズムになります。
DNAメチル化の維持機構
当研究室では特にDNAメチル化の維持機構に着目しています。哺乳類のDNAメチル化はDNAメチル化酵素の働きによって、5’-CG配列中のシトシンの5位に起こります。分化した細胞の実に7~8割のCG配列中のシトシンがメチル化されています。DNAメチル化はヘテロクロマチン形成に関与し、遺伝子発現抑制に寄与するエピジェネティックマークです。つまり、細胞は分化する時に不要な遺伝子にDNAメチル化のマークをつけます。
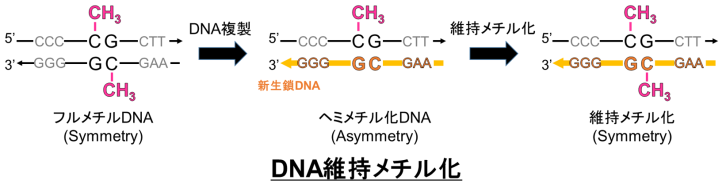
CG配列は回文配列なのでDNAの両鎖に対称的にメチル化 (フルメチル化) が起こり、これが生体内で機能します。DNA複製では、半保存的複製によりDNAポリメラーゼが塩基配列情報を引き継いだ新生鎖を合成します。しかし、この時にメチル化の情報は引き継がれないので、複製後には親鎖のみがメチル化された非対称なメチル化状態(ヘミメチル化)が一過的に生じます。この非対称なヘミメチル化を対称的なフルメチル化状態に戻し、有糸分裂が起こることでDNAメチル化の情報が次世代の細胞に継承されます。
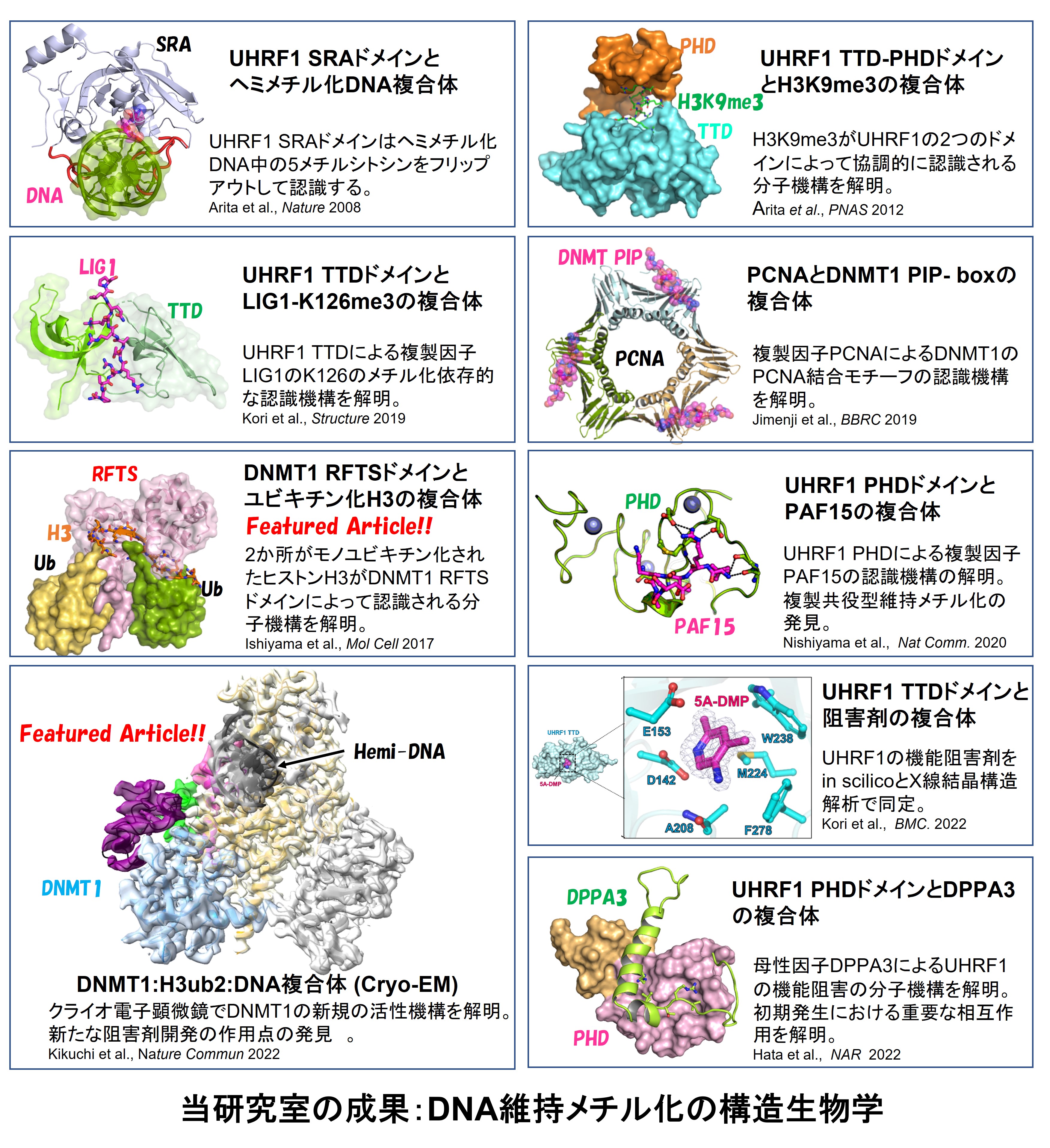
近年DNA維持メチル化は2つのユビキチンシグナルが関与することと、DNA複製期 (S期) の異なるタイミングで起こることがわかってきました (Nishiyama Nat Comm 2020)。複製直後では、ユビキチンE3酵素UHRF1が複製因子PAF15をユビキチン化し、これがDNAメチル化酵素DNMT1を複製鎖に呼び込み新生鎖をメチル化します。一方で複製から遅れた領域では、UHRF1はヌクレオソーム中のヒストンH3をユビキチン化してDNMT1をヘミメチル化DNAに呼び込み新生鎖をメチル化します。つまり、UHRF1が時空間的に異なるタイミングで異なるタンパク質をユビキチン化することでDNA維持メチル化が成し遂げられ、DNA維持メチル化の堅牢性が保たれています。
DNA維持メチル化の構造生物学
当研究室では、DNA維持メチル化の過程で形成される重要な生体分子複合体の構造生物学的な研究により、DNA維持メチル化の分子機構の解明に貢献してきました。これまではX線結晶構造解析を中心としたタンパク質ドメイン (タンパク質の一部でその領域だけで構造と機能を持つ領域) に着目した研究により、重要な生体分子の相互作用を明らかにしてきました。現在ではクライオ電子顕微鏡単粒子解析を取り入れ、複雑な生体分子複合体を試験管内で再構成して、ヌクレオソームを足場にしたDNA維持メチルやDNAポリメラーゼを含んだ複製因子とDNA維持メチル化因子複合体による複製と連携した維持メチル化の分子機構の解明を目指しています。
研究のキーワード
- 構造生物学:クライオ電子顕微鏡、X線回折・散乱法でエピジェネティクス関連タンパク質の立体構造解析を行い、その機能を解明する
- エピジェネティクス:DNAメチル化やヒストン修飾。遺伝子発現抑制的なヒストンH3K9me3修飾に関する研究も行っています。
- DNA維持メチル化:細胞運命の本体であるDNAメチル化が維持されていく分子機構の解明を目指しています。
- 複合体再構成:ヒストン修飾やDNAメチル化修飾を含むヌクレオソームの再構成、複製複合体を試験管内で高純度に再構成しています。
共同研究
- Dr. Pierre-Antoine Defossez (France CNRS, Epigenetics and Cell Fate)
- Dr. Heinrich Leonhardt (Germany LMU München, Department of Biology II)
- 中西 真 先生, 西山 敦哉 先生 (東京大学 医科学研究所 癌防御シグナル分野:アフリカツメガエル卵抽出液を用いたDNA維持メチル化の解析)
- 鵜木 元香 先生 (東京大学大学院医学系研究科 国際保健学専攻 人類遺伝学:クロマチンリモデリング因子やUHRF1関連の研究で共同研究)
- 古寺 哲幸 先生 (金沢大学 ナノ生命科学研究所:高速AFM観察)
- 林 剛介 先生 (名古屋大学大学院 工学研究科 生命分子工学専攻 生体分子応用化学研究室:ユビキチン化タンパク質の化学合成)
- 小沼 剛 先生 (横浜市立大学 生命医科学研究科 構造エピゲノム研究室:NMR解析)



