構造エピゲノム科学研究室 明石グループの研究成果を掲載
2020.05.07
- TOPICS
- 研究
- 学生の活躍
ネイティブ質量分析による夾雑環境下でのタンパク質-リガンドスクリーニング系の構築 (構造エピゲノム科学研究室 明石グループ)
発表者:高野 航太朗1 (2018年度前期課程修了), 荒井 駿佑1 (前期課程1年), 坂本 清志2, 牛島 弘嗣1 (前期課程2年), 池上 貴久1, 七種 和美1,3 , 小沼 剛1, 浜地 格2, 明石 知子1
⇒Research map
研究分野:構造生物化学
キーワード: ネイティブ質量分析、未精製タンパク質、スクリーニング
1構造エピゲノム科学研究室
2京都大学工学研究科
3産業技術総合研究所
⇒Research map
研究分野:構造生物化学
キーワード: ネイティブ質量分析、未精製タンパク質、スクリーニング
1構造エピゲノム科学研究室
2京都大学工学研究科
3産業技術総合研究所
研究成果のポイント
- リコンビナントタンパク質を大腸菌で発現させたのち、精製せずに特異的なリガンドとスクリーニングする手法を、ネイティブ質量分析法を用いて構築
- 生理的環境に近い状態で、複数の化合物から特異的に相互作用をする化合物を見出すことが可能
発表雑誌
論文タイトル:Screening of protein-ligand interactions under crude conditions by native mass spectrometry
著者:Takano K, Arai S, Sakamoto S, Ushijima H, Ikegami T, Saikusa K, Konuma T, Hamachi I, *Akashi S.
雑誌名:Analytical and Bioanalytical Chemistry doi: 10.1007/s00216-020-02649-x
著者:Takano K, Arai S, Sakamoto S, Ushijima H, Ikegami T, Saikusa K, Konuma T, Hamachi I, *Akashi S.
雑誌名:Analytical and Bioanalytical Chemistry doi: 10.1007/s00216-020-02649-x
説明
ある特定のタンパク質がターゲットとする分子を同定する場合や、あるタンパク質に特異的に結合してその機能を阻害する分子を探索する場合、一般に、精製されたリコンビナントタンパク質を用いて、物理化学的な実験手法で候補化合物との相互作用の有無が検証されます。
この方法では、精製されたタンパク質との化学量論的な相互作用(stoichiometric interaction)を制御された実験条件下で検出するのが一般的です。
しかしながら、このような実験系は、実際の生体内での夾雑かつ複雑な系とはかけ離れており、より生体内に近い環境で相互作用を判定できれば大きなアドバンテージになります。
一方、質量分析の手法の一つ、ネイティブ質量分析では、特異的な相互作用により形成されたタンパク質-リガンド複合体を壊さずにイオン化し、複合体丸ごとの質量を決定することができます。
これまでに、精製されたタンパク質を用いてネイティブ質量分析に有利な実験条件を用いる場合は多くの報告があるものの、生理的環境に近い条件でのネイティブ質量分析は困難を極めるため、夾雑環境下でのこの手法による化合物のスクリーニングは報告例がありませんでした。
そこで私たちは、大腸菌発現系を用いて作成した未精製のリコンビナントタンパク質を用いて、特異的なタンパク質-リガンドの相互作用を検出し、スクリーニングする手法をネイティブ質量分析で構築することに挑戦し、実験条件を精査することで、方法を確立することに成功しました。
なお、本研究は、京都大学工学研究科・浜地格研究室との共同研究です。
この方法では、精製されたタンパク質との化学量論的な相互作用(stoichiometric interaction)を制御された実験条件下で検出するのが一般的です。
しかしながら、このような実験系は、実際の生体内での夾雑かつ複雑な系とはかけ離れており、より生体内に近い環境で相互作用を判定できれば大きなアドバンテージになります。
一方、質量分析の手法の一つ、ネイティブ質量分析では、特異的な相互作用により形成されたタンパク質-リガンド複合体を壊さずにイオン化し、複合体丸ごとの質量を決定することができます。
これまでに、精製されたタンパク質を用いてネイティブ質量分析に有利な実験条件を用いる場合は多くの報告があるものの、生理的環境に近い条件でのネイティブ質量分析は困難を極めるため、夾雑環境下でのこの手法による化合物のスクリーニングは報告例がありませんでした。
そこで私たちは、大腸菌発現系を用いて作成した未精製のリコンビナントタンパク質を用いて、特異的なタンパク質-リガンドの相互作用を検出し、スクリーニングする手法をネイティブ質量分析で構築することに挑戦し、実験条件を精査することで、方法を確立することに成功しました。
なお、本研究は、京都大学工学研究科・浜地格研究室との共同研究です。
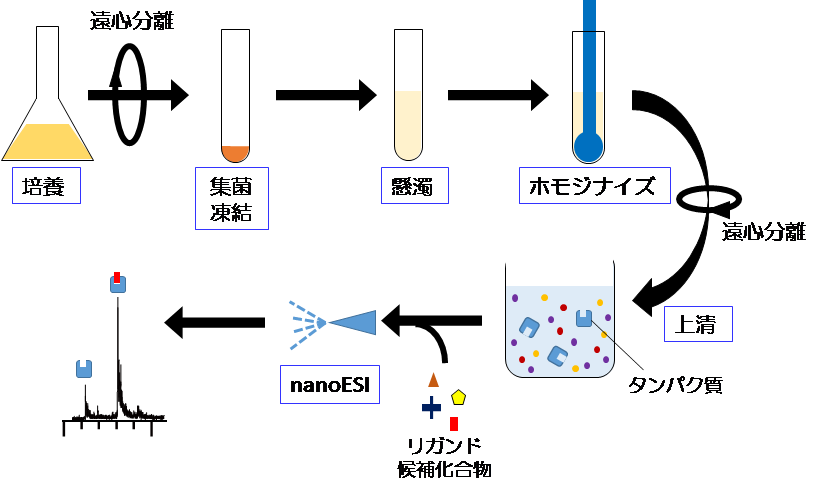 図1. 今回開発した手法の概略
図1. 今回開発した手法の概略
今回構築した手法の概略を図1に示します。
大腸菌発現系を利用してモデルタンパク質DHFRを調製後、大腸菌の細胞膜を凍結・融解後ペッスルで破壊し、DHFRを回収します。
続いて得られた未精製のDHFRの溶液に、複数のリガンド候補化合物を加えてそのままネイティブ質量分析に供します。
化合物の添加の有無でスペクトルを比較することで、増加した質量から特異的に結合するリガンドを同定する手法を、夾雑環境下で構築しました。
試料調製の実験方法を精査した結果、8個の化合物のなかから特異的に結合する一つの化合物(メトトレキサート)を見いだせることを立証しました。
研究費:科研費(JP18H04561 (S.A.), JP17K07313 (S.A.), JP19H05774 (S.A.), JP19K16091 (K.S.))、AMED BINDS(JP19am0101076 (S.A.))、JKA財団(T.K.),
大腸菌発現系を利用してモデルタンパク質DHFRを調製後、大腸菌の細胞膜を凍結・融解後ペッスルで破壊し、DHFRを回収します。
続いて得られた未精製のDHFRの溶液に、複数のリガンド候補化合物を加えてそのままネイティブ質量分析に供します。
化合物の添加の有無でスペクトルを比較することで、増加した質量から特異的に結合するリガンドを同定する手法を、夾雑環境下で構築しました。
試料調製の実験方法を精査した結果、8個の化合物のなかから特異的に結合する一つの化合物(メトトレキサート)を見いだせることを立証しました。
研究費:科研費(JP18H04561 (S.A.), JP17K07313 (S.A.), JP19H05774 (S.A.), JP19K16091 (K.S.))、AMED BINDS(JP19am0101076 (S.A.))、JKA財団(T.K.),
問い合わせ先
TEL: 045-508-7217, FAX: 045-508-7362
E-mail: akashi@yokohama-cu.ac.jp