生命医科学研究科博士前期課程1年木村一雅さん、GlycoTOKYO2019シンポジウムでポスター賞受賞!
2019.11.21
- TOPICS
- 研究
- 学生の活躍
- 教育
- 大学
生命医科学研究科博士前期課程1年木村一雅さん、GlycoTOKYO2019シンポジウムでポスター賞受賞!

発表演題「iPSC由来神経特異的細胞膜糖ペプチド網羅的解析法の開発」
大学院生命医科学研究科博士前期課程1年の木村一雅さん(指導教員:川崎ナナ教授)は、 2019年11月16日(土)に埼玉大学(埼玉県さいたま市)で開催されたGlycoTOKYO2019シンポジウム(第20回記念大会)においてポスター発表を行い、ポスター賞に選出されました。表彰式は、 同大会の交流会で執り行われました。
受賞者
生命医科学研究科 博士前期課程 1年 木村一雅(きむら かずまさ)さん
発表演題
「iPSC由来神経特異的細胞膜糖ペプチド網羅的解析法の開発」
発表者
木村一雅、 太田悠葵、 小泉 匠、川崎ナナ
受賞者
生命医科学研究科 博士前期課程 1年 木村一雅(きむら かずまさ)さん
発表演題
「iPSC由来神経特異的細胞膜糖ペプチド網羅的解析法の開発」
発表者
木村一雅、 太田悠葵、 小泉 匠、川崎ナナ
木村一雅さんのコメント
数ある発表のなかから、 このような名誉ある賞に選出していただき心より嬉しく思います。川崎ナナ教授をはじめとする創薬再生科学研究室の皆様からの熱心なご指導とご支援・ご協力の賜物です。この場をお借りして、 厚く御礼申し上げます。
発表当日は、 様々な分野の方々とのディスカッションを通して新たな視点、 また、 自分の未熟な点を改めて知ることができました。本学会で受けた刺激を励みに、 より一層研究活動に邁進したいと思います。
発表当日は、 様々な分野の方々とのディスカッションを通して新たな視点、 また、 自分の未熟な点を改めて知ることができました。本学会で受けた刺激を励みに、 より一層研究活動に邁進したいと思います。
指導教員 川崎ナナ教授のコメント
受賞おめでとうございます。木村君はiPS細胞由来神経細胞を利用した再生医療や創薬研究の実用化に資する研究として、質量分析を用いてiPS細胞由来神経細胞膜に特異的に存在する糖タンパク質を見つけ出し、それを用いた細胞品質評価や選別法を開発することをめざしています。この研究の遂行には、iPS細胞の培養・神経分化と、質量分析という2つの高度な技術の修得が要求されます。また、質量分析によるiPS細胞膜由来糖タンパク質の探索には、細胞膜から糖ペプチドを回収する方法の開発が不可欠でした。木村君は休むことなく研究室に通って実験を続け、この2つの技術を修得しました。また、根気強く糖ペプチド回収のための条件検討を重ね、ついに最適な条件を見出しました。研究と並行して、関連するいくつもの学会に参加し、学会発表方法を学びました。このような努力が実を結び、受賞につながったのだと思います。今回の受賞対象となった研究成果が、今後どのような研究結果を生み出すのか、楽しみにしています。
発表内容
iPSC由来神経細胞は、 神経疾患の治療や、 医薬品の安全性評価などへの応用が期待されています。
現在、 iPSCの神経分化は主に形態学的、 免疫学的、 電気生理学的手法により評価されていますが、 これら手法は特異性や定量性において課題が残されています。
細胞表面糖タンパク質は、 細胞分化によって変化することが知られています。
そこで我々は、 特異性や定量性が高く、 細胞選別にも応用できる手法として、 細胞膜表面糖タンパク質を分化マーカーとする方法の開発を目指しています。
膜表面糖タンパク質の網羅解析にはLC/MS/MSは大変強力かつ有用な方法です。
しかし、 (1) 糖ペプチドはペプチド共存下ではイオン化抑制を受け検出が難しい、 (2) 疎水性が高い糖ペプチドは吸着による検出低下が起きやすい、という課題がありました。
我々は、 (1) への対応としてセルロースの親水性相互作用を利用した固相抽出による糖ペプチド濃縮法を開発しましたが、 細胞由来の多量の糖ペプチドを濃縮するにはかなりの時間を要するという課題がありました。
そこで今回、バッチ処理で一度に大量かつ迅速に濃縮を行う手法の開発を試みました。
つぎに、 2) の吸着の抑制のために試料溶媒の最適化を行いました。
さらに、 iPSC、 iPSC由来神経細胞を用いて、 本法が膜表面糖タンパク質の網羅的解析に応用可能か検証を行いました。
その結果、全部で1201個の糖タンパク質を同定することができました(図1)。
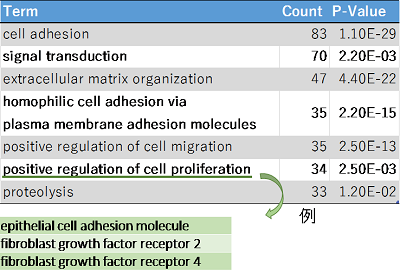
Gene Ontology解析を行ったところ、それらは、主に細胞接着に関わる糖タンパク質であることが分かりました。
さらに、iPSCでは自己複製、神経幹細胞では神経発達など、神経前駆細胞では軸索ガイダンス、ドパミン作動性神経ではシナプス伝達など各細胞機能に特徴的な糖タンパク質がエンリッチメントされていました(表1)。
このことより、本法は、iPSC由来神経細胞の網羅解析に利用可能であることが分かりました。
現在、 iPSCの神経分化は主に形態学的、 免疫学的、 電気生理学的手法により評価されていますが、 これら手法は特異性や定量性において課題が残されています。
細胞表面糖タンパク質は、 細胞分化によって変化することが知られています。
そこで我々は、 特異性や定量性が高く、 細胞選別にも応用できる手法として、 細胞膜表面糖タンパク質を分化マーカーとする方法の開発を目指しています。
膜表面糖タンパク質の網羅解析にはLC/MS/MSは大変強力かつ有用な方法です。
しかし、 (1) 糖ペプチドはペプチド共存下ではイオン化抑制を受け検出が難しい、 (2) 疎水性が高い糖ペプチドは吸着による検出低下が起きやすい、という課題がありました。
我々は、 (1) への対応としてセルロースの親水性相互作用を利用した固相抽出による糖ペプチド濃縮法を開発しましたが、 細胞由来の多量の糖ペプチドを濃縮するにはかなりの時間を要するという課題がありました。
そこで今回、バッチ処理で一度に大量かつ迅速に濃縮を行う手法の開発を試みました。
つぎに、 2) の吸着の抑制のために試料溶媒の最適化を行いました。
さらに、 iPSC、 iPSC由来神経細胞を用いて、 本法が膜表面糖タンパク質の網羅的解析に応用可能か検証を行いました。
その結果、全部で1201個の糖タンパク質を同定することができました(図1)。
Gene Ontology解析を行ったところ、それらは、主に細胞接着に関わる糖タンパク質であることが分かりました。
さらに、iPSCでは自己複製、神経幹細胞では神経発達など、神経前駆細胞では軸索ガイダンス、ドパミン作動性神経ではシナプス伝達など各細胞機能に特徴的な糖タンパク質がエンリッチメントされていました(表1)。
このことより、本法は、iPSC由来神経細胞の網羅解析に利用可能であることが分かりました。
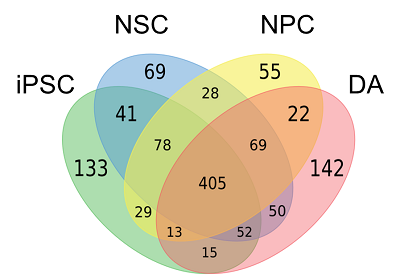
図1. 各細胞で同定された糖タンパク質