研究内容
当研究グループでは、疾患(主に神経疾患)に関係するタンパク質について、(1)タンパク質がその本来の機能を発現する分子メカニズム、(2)変異導入や相互作用形成など
によるタンパク質の構造や機能の変化が、疾患を引き起こすメカニズムを明らかにする研究を進めています。これらの研究により得られた成果
を、医学・薬学応用に繋げることを目標として研究を行っています。
シャルコー・マリー・トゥース病の疾患メカニズムの解明研究
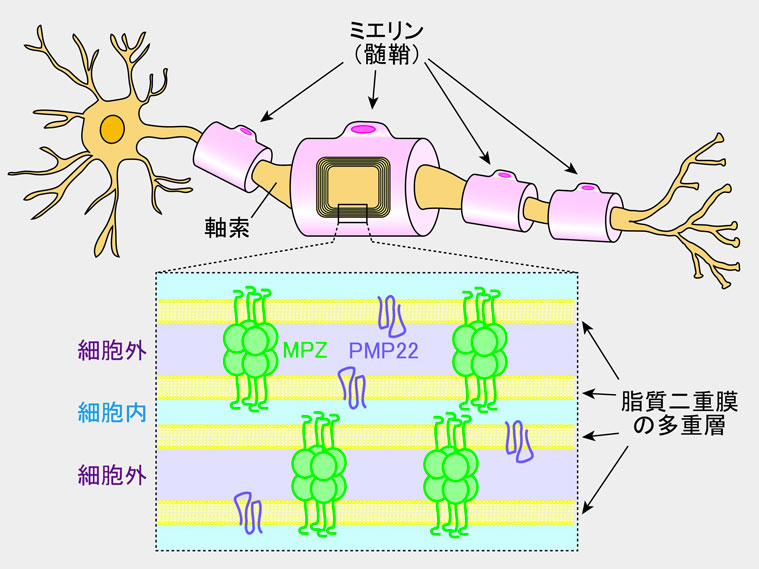
神経の軸索は、細胞(末梢神経ではシュワン細胞)がぐるぐる巻き付いたミエリン(myelin、髄鞘とも呼ばれ
ます)という電気絶縁体に覆われています。ミエリンは跳躍伝導による神経伝導の高速化に必要不可欠な生体構造です。
ミエリンの電気絶縁性は、細胞が巻き付くことよって形成される脂質二重膜の多重層によりもたらされます。特にコンパク
トミエリ ンと呼ばれる領域において、脂質二重膜は規則正しく、膜と膜の間の距離が4-5 nm(= 4-5×10-9
m)になるように重なっています。このような膜多重層の形成には、脂質二重膜中あるいはその表面に存在するタンパク質群が関与しています。
ミエリンのタンパク質の状態が変化すると、“タマネギの球根”のように見える異常ミエリンが現れることがあります。異
常ミエリンに覆われた末梢神経は伝導速度が低下し、手足の末端に神経シグナルを伝えにくくなります。この結
果、手足の筋力低下、筋肉の萎縮、無感覚などの症状が現れます(1型シャルコー・マリー・トゥース病;CMT1)。CMT1は10-20代の若年
期に発症することが多く、患者は長い期間にわたって療養生活を送らなければなりません。ところが、CMT1の発症メカニズムは明らかにされておら
ず、根本的な治療方法、治療薬も開発されていません。このためCMTは厚生労働省により難病に指定されています。
CMT1を引き起こす遺伝子異常で最も多いのは、PMP22(Peripheral Myelin
Protein
22;末梢ミエリンタンパク質22)という膜タンパク質をコードする遺伝子の倍化です。PMP22については、(1)そもそもミエリンにおいてどのような働きをするタンパ
ク質なのか、(2)どのような形をしているのか、(3)遺伝子倍加によって何が起こり、なぜ脂質二重膜の多重層化が阻害されるのか、など多くのこ
とが解明されていません。
一方、MPZ(Myelin Protein
Zero;ミエリンタンパク質ゼロ。P0とも呼ばれる)というタンパク質をコードする遺伝子へのミスセンス変異の導入も、CMTを引き起こすことがあります。MPZ
は膜と膜を接着する機能を持っていると考えられており、CMT誘起性のアミノ酸置換はこの膜接着能に影響を与えると考えられますが、その詳細は解
明されていません。
坂倉グループでは、CMTの原因遺伝子産物であるPMP22とMPZを標的として、これらの
タンパク質の機能および構造を明らかにするための機能・構造解析を進めています。構造解析においては、標的タンパク質のリコンビナント体の調製が第一歩
となります。我々は一般的な大腸菌発現系に加えて、酵母を用いたリコンビナントタンパク質調製システムの開発を行っています。ミエリンに存在する
タンパク
質の多くは脂質二重膜との複合体として存在します。我々は、タンパク質-脂質複合体の構造解析を行うための研究ツールの開発にも取り組んでいま
す。構造解析実験では、核磁気共鳴法(NMR)、電子顕微鏡、X線結晶構造解析法等の様々な分析手法を、目的に応じて使い分けています。特に
NMRについては、横浜市立大学鶴見キャンパスに設置された国内有数の測定装置を使用した高度な解析実験を行っています。
私たちのグループは、これまでに、ヒトのMPZの細胞外ドメイン(Extracellular
Domain: ECD)が多量体化した状態の立体構造を決定することに成功しました(PDB 8IIA )。
これにより、ECDとECDがどのようなメカニズムで結合するのかを、原子レベルで理解することが可能となりました。
一方、私たちは、粒子状のミニ脂質二重膜(=ナノディスク)の表面にECDを固定化した”疑似的な”ミエリン膜を作製し、その形状を電子顕微鏡で観察しました。す
ると、ナノディスク(=脂質二重膜)が、ECD8量体を介して数珠つなぎになった構造体『ナノミエ
リン』が観測され、ECDが8量体を形成することにより、膜と膜を接着することが明らかになりました。こ
ちら をご覧ください。
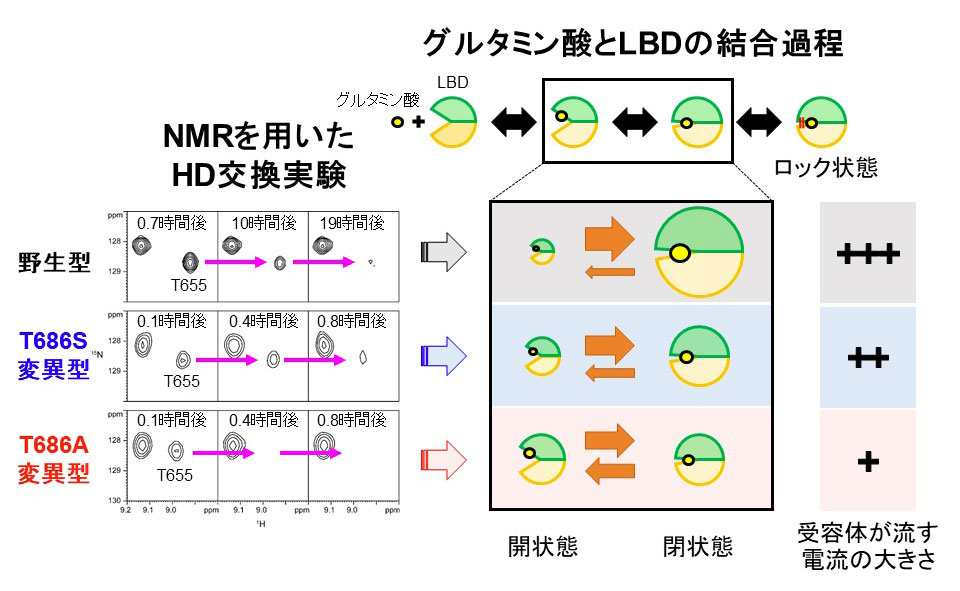
AMPA型グルタミン酸受容体の活性化メカニズムの解明研究
中枢において興奮性シナプス伝達を担うAMPA型グルタミン酸受容体(AMPA受容体)の活性化メカニズムを明ら
かにするためのNMR構造解析を行っています。詳細はこ
ちら をご覧ください。
アミロイド前駆タンパク質の構造解析研究
アルツハイマー病の原因と考えられているアミロイドβペプチド(Aβ)の前駆体タンパク質(Amyloid
Precursor Protein ; APP)の構造解析研究を行っています。