ここでは NMR グループで研究している内容について簡単に紹介いたします。
(1)同種多量体蛋白質におけるアロステリック効果の解明
蛋白質の中には同じ形をもったサブユニットと呼ばれる単位がいくつか集まってできている分子がしばしば見られます。サブユニットはドメインとは異なります。例えば3つのドメインから出来ている蛋白質の場合、N-末端と C-末端をつかんで引っ張ると、3つのドメインはつながったまま伸びます。ところが、3つのサブユニットから成っている蛋白質では、3つはばらばらになり、それぞれに N-末端と C-末端があります。我々の身近にある同種多量体蛋白質では、たとえばヘモグロビンが挙げられます。血液が赤色に見えるのはヘモグロビンによるものです。このヘモグロビンは、肺では酸素を受け取りますが、血流にのって体のあちこちに運ばれた先では逆に酸素を放します。同じヘモグロビンという蛋白質が、どのようにして肺では酸素と結びつき、その他の体の隅々では逆に酸素を放すのでしょう?
ここで酵素などの蛋白質にリガンドとよばれる物質がくっつくような状況を考えてみます。リガンドとしては補酵素や基質、阻害剤などさまざまなケースが考えられます。酵素の周りにリガンドがたくさん泳いでいれば、それらのリガンドはどんどん酵素にくっついていきます。逆に酵素の周りにリガンドがほとんど泳いでいなければ、酵素についているリガンドは酵素からどんどん離れていきます。このように、酵素とリガンドが溶液のなかに共存していると、泳いでいるリガンドの数が多ければ、酵素にさらにくっつくことによって泳いでいるリガンドの数が減り、逆に泳いでいるリガンドの数が少なければ、すでに酵素についているリガンドが放されて泳いでいるリガンドの数が増えるといった働きが自然に起こるのです。ルシャトリエの法則という形で高校で習った方も多いかと思います。
体内の数えきれないほどの種類の酵素も、このような自然法則により我々の体の中でお互いにバランスを取り合いながら働いているはずです。ところが、この程度のバランス様式ではヘモグロビンのように酸素を付けたり放したりを急に切り替えるのにはちょっと間に合わないのです。そこで、肺では酸素ともっと積極的に結びつき、筋肉などでは酸素をもっと積極的に離すために、ヘモグロビンでは4量体という形が進化の過程で生み出されました。昔の単純な生物では単量体だったのです。そのような下等生物(と蔑む程には解明されていませんが)では、せっかく酸素をヘモグロビンに類する蛋白質に付けても、体の隅々で放すことを忘れてそのまま酸素をもって返ってきてしまうような非効率的なことが起こっているのでしょう(お土産をお客さんの所に持って行ったまではよいが、渡し忘れてそのまま持って返ってきてしまった?)。
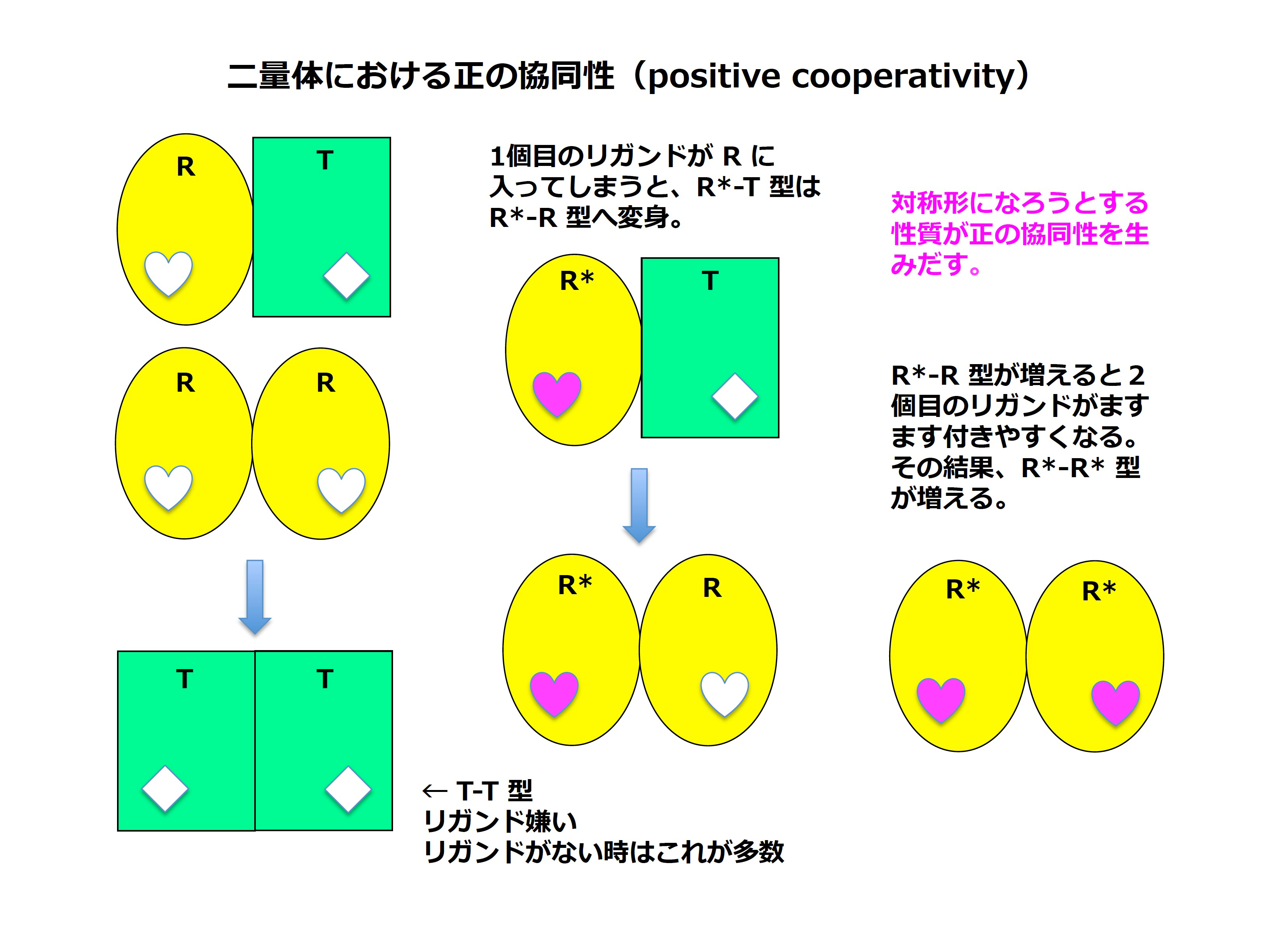
この4量体は4つのサブユニットから成っていますが(正確には α2β2 なのですが、細かい点は無視しましょう)、それぞれのサブユニットに酸素分子が1つずつ付きます。面白いことに1つめの酸素があるサブユニットに、2つめの酸素が次のサブユニットにと付き始めると、残りのまだ酸素が付いていない空のサブユニットもいっしょに一斉に酸素が付きやすい形に変身するのです。逆に酸素が4つ付いている状態をみてみます。肺から出てちょうど体の隅々に辿り着いた時です。あるサブユニットから一つめ、次のサブユニットから2つめと酸素が離れ始めると、残りのサブユニットもいっしょに同時に酸素が付きにくい(つまり放しやすい)形に変わるのです。このような現象をアロステリック効果と呼びます。
アロステリック効果はさまざまな現象を指す言葉ですが、ここでは同種多量体蛋白質への同種リガンド結合におけるアロステリック効果(the homotropic allosteric effect in a homomultimer)を研究しています。ヘモグロビンは「ますます酸素が付き易い or ますます酸素を放し易い」と相互作用が両極端な方のどちらかに急に傾くのでした。まるでスィッチを on/off する様子に似ています。これを「正の協同性 positive cooperativity」と呼びます。正の協同性を起こす蛋白質では、すべてのサブユニットが一斉に形を換えて同じ形になるように揃いますので、常にきれいな星形のような幾何学的な対称性が見られることが多いです。そのため、きれいな結晶もでやすく、昔から X-線結晶構造解析によって多くの立体構造が解析され詳しく研究されてきました。ところが、この「正の協同性」とは逆の「負の協同性 negative cooperativity」も少なからずあるのです。実は、両者の数は我々の体内に同じぐらい存在するとも言われているのですが、この負の協同性をもつ蛋白質はリガンドが中途半端についた状態では対称形をとらず、そのため結晶を出すのも難しいのです。また「負の協同性」がそもそもなぜ存在するのかの意義もはっきりと分かっておらず、そのメカニズムについても多くの衝突する議論が交わされています。
このつい先日、負の協同性がなぜ生体内に存在するのかの意義について、あっと驚く結果が発表されました。言われてみるまで気づきませんでした。コロンブスの卵です。
負の協同性は突き詰めていくと非対称性の方が安定という性質につながります。しかし、例えば同種二量体を考えた時に、なぜ左右非対称形が対称形より好まれてしまうのか?我々はとかく対称という美に惹かれてしまい「対称=安定」という先入観に惑わされているだけなのかもしれません。
非対称性の方がよい例として、たとえばお互いに変わり番子に役割を交代しながら2サブユニットの酵素が働いている場合が考えられます。左のサブユニットが第1ステップを触媒している間は、右のサブユニットは第2ステップを触媒している。そして、次の瞬間、お互いのステップを入れ替えるような酵素です。ステップ数が多くなれば、ATPase のように3ステップに増やしてもよいでしょう。ちょうどロータリーエンジンのような感じになります。このような事例を考えていくと、多くの蛋白質で homomultimer という形態が進化の過程で選ばれてきた理由が何気なく分かってきます。

(2)蛋白質分解酵素の阻害
病気や怪我をすると我々はよくお医者さんで抗生物質をもらいます。ところが、この抗生物質を簡単に分解してしまうようなすごい酵素をもっている細菌類がいるのです。そのような細菌類を撲滅できればよいのですが(実際にそうしてしまうと自然界のバランスが崩れてしまってまずいでしょうが)、なんとそのような細菌類は、自分のその酵素の遺伝子(プラスミド)を、そのような遺伝子をもっていない細菌類にせっせと分け与えてしまうのです。すると、遺伝子をもらった後者の細菌類も抗生物質を分解できるように変身「進化?」してしまいます。この頃はこのような事態が次々に起こってしまい、多くの細菌が集まるような巨大病院では、人類がこれまでに苦労して発見したり作り上げてきたありとあらゆる種類の抗生物質をもササッと分解できるようなスーパー細菌が誕生しはじめているのです。このような細菌に感染してしまうと、もういかなる抗生物質でも歯が立ちません。
最後の砦といわれている抗生物質バンコマイシンをも無効にしてしまう菌もおり、この菌が使うある酵素を働かなくしてしまいさえすれば、この恐ろしいバンコマイシン耐性に打ち勝つことができることが分かっています。そこで、この酵素がどのような形をしているのか、どのようにして働くのかを調べています。ところが、この酵素はそのように深く調べようとすると、すぐに凝集して沈殿してしまうため、世界的に注目を集めながらもあまり研究が進んでいないのです。そこで、凝集や沈殿を防ぐにはどのようにすればよいのかということも同時に研究しています。実はこの凝集のメカニズムは、パーキンソン病やアルツハイマー病のように頭の中で蛋白質が凝集、沈着していく現象のメカニズムとそっくりなのです。
凝集や沈殿を防ぐにはさまざまな方法がありますが、大きく「蛋白質が翻訳されていく過程での蛋白質の折り畳みが変」か「翻訳の時にはちゃんと折り畳まれたのであるが、その後の溶媒条件が変」の2つに分けられます。そのうち前者についても多くの解決法がありますが、すぐに試せる方法の1つとしては、ここをご覧ください。
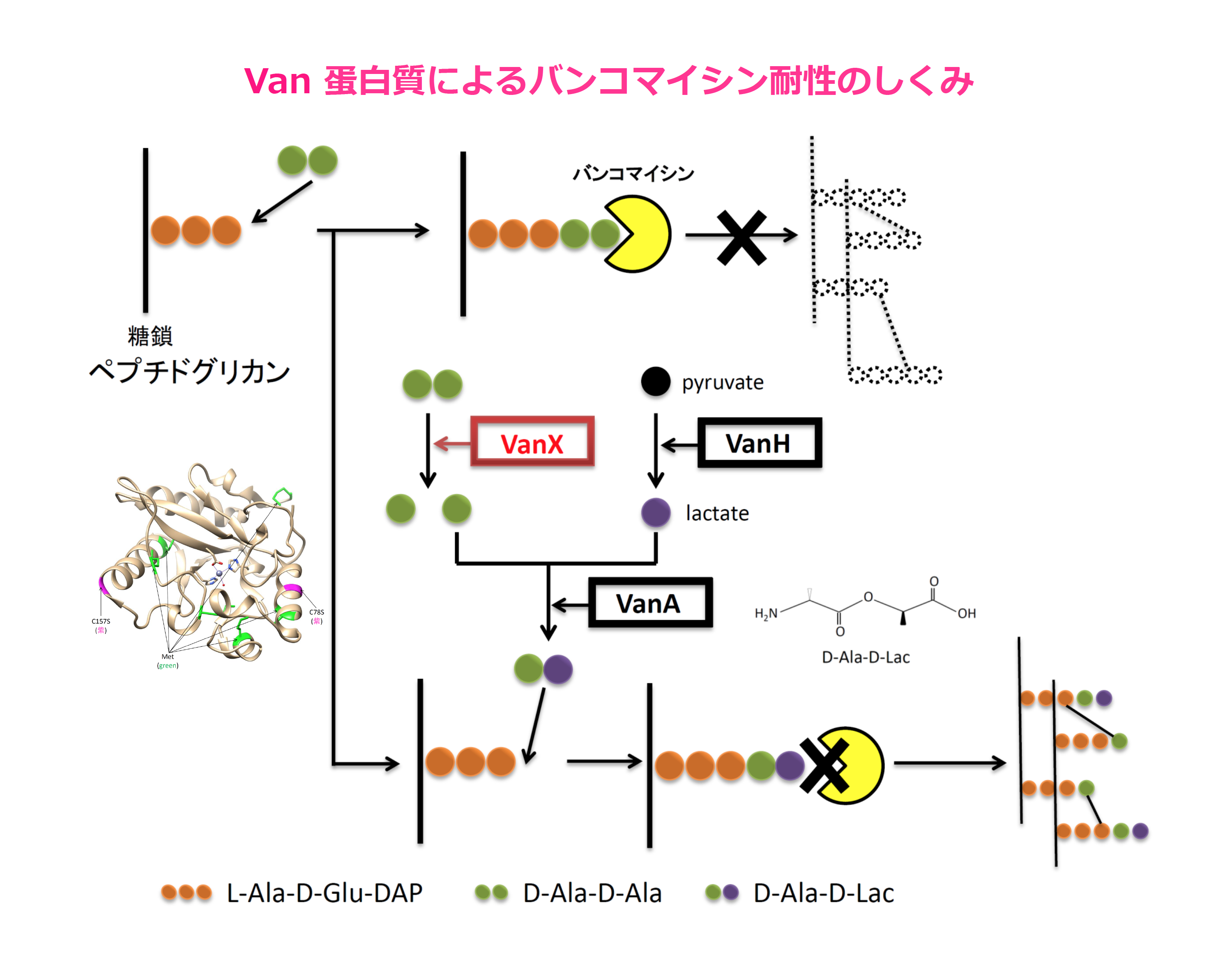
この蛋白質の立体構造はすでに X-線結晶構造解析によって分かっています。ところがその座標値をみると、6個が一列に並んでいます。まさか同種6量体?つまり1単位としての構造はよく分かっているのですが、それがどのように寄り集まっているのか?については結晶内の環境が実際の溶液内の環境と異なるため、よく分かっていません。そこで溶液内での本当の姿を観れるような計測法として NMR, 超遠心, SAXS などを使っています(or 予定です)。また、ここに阻害剤の候補を入れて実際に相互作用しているかどうか、活性が阻害されているかどうかを観るには NMR が最適です。NMR スペクトルでは個々の原子がピークとして現れますので、阻害剤を入れる前と後とを比べるとよいわけです。それにはどのピークがどの原子に対応しているかを事前に調べておく必要があるのですが、実はこの酵素でもっとも難しい点はこの帰属と呼ばれるステップでした(理由は多量体化とその4次構造の交換でした)。しばしば、最近の技術の進歩により数週間以内で帰属が完成してしまうような報告も見受けられます。確かに早ければ1日で帰属おわりという蛋白質もありました。しかし、実際には何度も諦めたくなるような状況を 20 年近くも続けないといけないような今回のケースもあります。それもそろそろ完成に近づいてきました。後は間違いがないかどうかのクロスチェックの実験だけです。
(3)キチン、セルロース分解酵素のしくみ
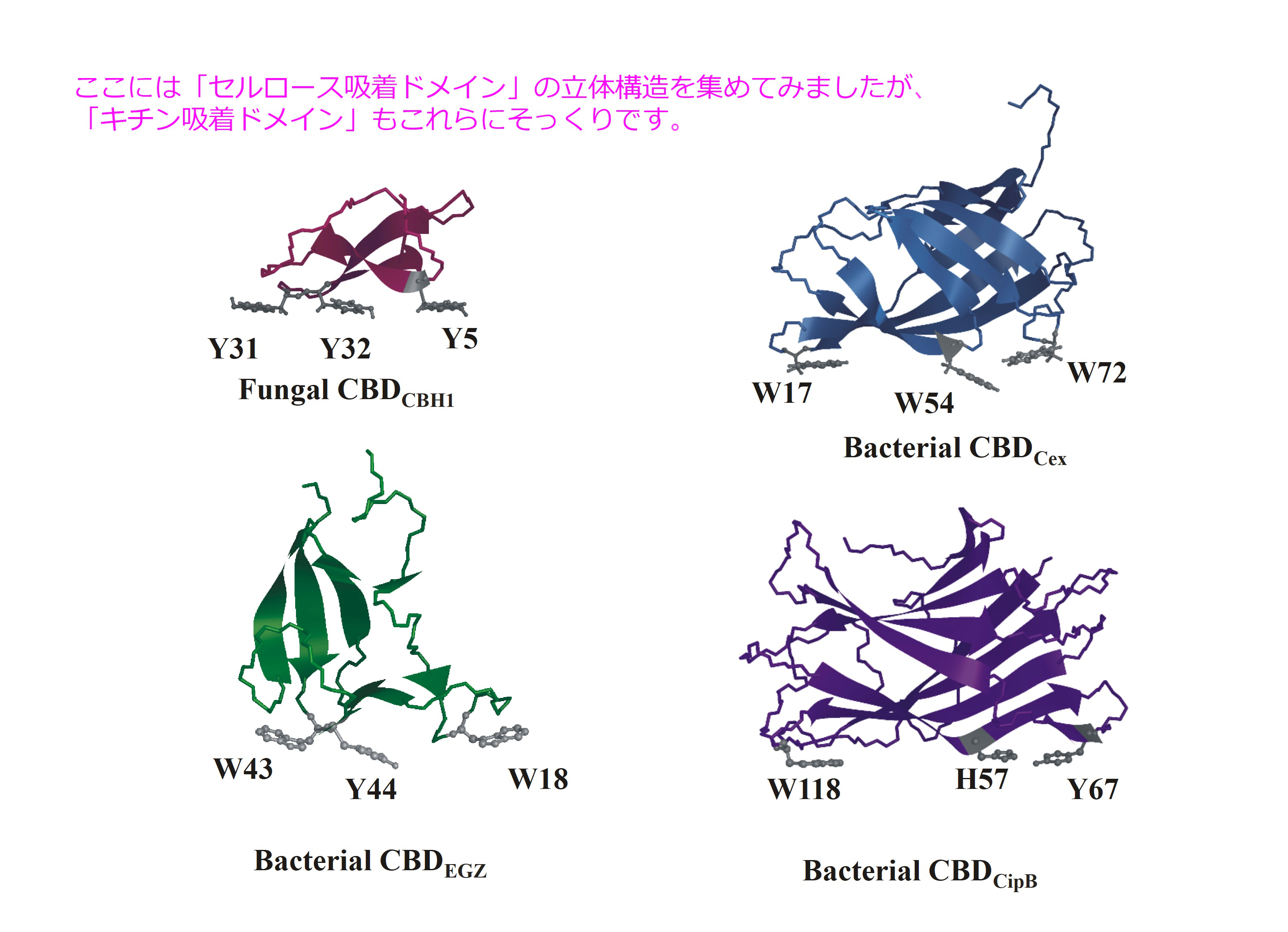
蟹や昆虫などの外骨格はたいへん頑丈ですが、これらはキチンと呼ばれる物質でできています。そして、キチンは植物の細胞壁であるセルロースとその化学構造が似ています。このようなキチンやセルロースを分解する酵素を我々も含め土の中に住んでいる土壌細菌も持っています。もし、そのような土壌細菌がいなければ、死んでしまった昆虫や蟹は分解されず、我々の周りは化石だらけになっていたことでしょう。それにうっかり蟹の甲羅を飲み込んでしまったら消化できずに大変なことになっていたことでしょう。そして、そのような土壌細菌がもっている分解酵素は、いくつかのドメインに分かれている場合が多いのです(N-末端のアミノ酸と C-末端のアミノ酸をつまんで引き伸ばした時に、全てのアミノ酸がつながっていればドメイン、つながっておらずバラバラになればサブユニットと呼びます)。そのドメインのうち、キチンやセルロースへ吸着(相互作用)するドメインについては、その立体構造がたくさん解析されています。ところが、キチンやセルロースなどの基質へどのようにして相互作用するのかについては実はよく分かっていないのです。その理由は、対象であるキチンやセルロースはかちこちの固体であり、これまでの分光学的な手法のほとんどが固体を対象とした研究には使えないためなのです。たとえば、分光光度計にキチンと分解酵素を入れたとしても、光は "キチン" と跳ね返されてしまいます(分散とよぶ)ので、分解酵素の形がどのように変わったのかなどを光(電磁波)で検出することができないのです。
キチン・セルロース吸着ドメインと呼ばれるドメインには、下図に示すように、2−3個の芳香環が蛋白質の表面に並んで外側に飛び出していることが多いです。一般的な蛋白質では芳香環は内側に向かっていることが普通で、そのためキチン・セルロース吸着ドメインの立体構造をはじめて前知識なしに解くと、非常に奇妙な形のため構造決定が失敗したのではないかと落ち込んでしまいます。それらの残基を別の芳香環ではないアミノ酸に変異すると吸着能力がなくなることから、一応それら芳香環が相互作用部位であろうと考えられています。しかし、この芳香環をもたない超変なドメインもあり(しかし、芳香環がないことを除いて他の構造的な特徴は他の吸着ドメインとまったく同じ)、これは一体どうやってキチンにだけくっつくのか?と謎になっています。このキチン吸着ドメインだけ、他のと違って別の表面でキチンにくっ付くのでしょうか?もしそうでしたら、他のキチン吸着ドメインも進化の過程で芳香環を失ってもよさそうです。あるいは、飛び出した芳香環でキチンやセルロースにくっ付くという考えがそもそも間違えているのでしょうか?確かに「固体の」キチンやセルロースの表面にこれら吸着ドメインがくっついた状態での結晶は1つもありません。また、キチンやセルロースへの吸着は疎水的な相互作用であると言われているのですが、それだけならば、水を嫌う表面になら何にでもくっついてしまうことになってしまいます。また、吸着ドメインには芳香環が飛び出しているのですから、それらどうしがベタベタとくっついて蛋白質どうしが凝集してしまうはずです。しかし、実際にはちゃんとキチンとセルロースを区別してしまう程に(どこを探しても鍵穴がみつからないのですが)鍵と鍵穴の関係がきっとあるのでしょう。このように基質特異性がしっかりと保たれている点は、立体構造をいくら眺めても分からず、たいへん不思議です。
以上がここで研究している主な内容ですが、これを調べるのに核磁気共鳴(NMR)という巨大な磁石をもった機械を使っています。なんだか恐ろしい名前のようですが、実は病院で頭の中の血管や捻挫した足などを撮像する MRI と同じ原理で動く機械です。NMR は縦向きに置かれており試料のガラス管を上から落とすように入れますが、MRI は対象が患者さんですので、横向きに寝たまま入ることが多いです。この NMR を使うと、0.3 cc ほどの水の中に溶けている(100,000,000,000,000,000 個ほどの)大量の蛋白質分子の中の(1分子につき)数千個の原子の中の原子核を観ることができます。たとえば、ある原子核と別の原子核の間の距離が分かります。このような距離がたくさん分かると、それらから分子の立体構造を組み立てることができます。また、これらの原子核がどのようにお互いに動きあっているのかも分かりますので、分子がどのように動くのかについても掴めるわけです。「MRI でそのようなものをお医者さんに診られてはいない」と思われる方もおられるでしょう。そのようなことはありません。皆さんの体の中の水(血液、細胞液など)H2O 中の水素原子 1H の中の水素核(これを陽子 proton とよびます)を観測することによって、その水がどのように流れているのか?止まっているのか?またドロドロ具合などが分かるのです。
病気を治すには、まずはどこが傷んでいて、どのような症状になっているのかを詳しく診察しなければなりません。その診察で MRI を使えばまったく痛みをともなうことなく、メスを入れることもなく癌の様子を透視することもできます。すると、その後で手術がたいへんしやすくなります。この MRI による診察がないと「ちょっとそこを切ってみてどこに癌があるか調べてみましょう。切ってみましたが残念ながら見つからなかったので、次は隣の場所を切って試してみましょう。」といった酷い事態になってしまいます。これと同じように、蛋白質を壊さずに NMR でよく調べることによって、この蛋白質の働きを抑えるような(あるいは、逆に活性化させるような)薬をつくることができるようになるわけです。しかし、その蛋白質を立体構造も含めて事前にちゃんと調べておかないと「何百万種類という化学物質をひとつひとつ合成しては、蛋白質にくっついて効くかどうかを試してみましょう。この No. 48,923 薬は効かなかったので、明日は次の No. 48,924 薬を試してみましょう。」という事態になってしまうのです。
また、工場の流れ作業を思いおこしてみましょう。そこでは 30 種類ぐらいの製品をつくっており、それぞれで流れ作業の工程が 200 ぐらいに枝分かれしているとします。とある製品を作り過ぎていることに急に気づいた場合、どの工程あるいは枝分かれを急ぎストップすればよいのでしょうか?全体の工程が単純だとすぐに分かりますが、下手にある箇所を止めると、中途半端に未完成の製品がどこかの工程で溜まってしまったり、また別の種類の製品が逆に足りなくなったりしてしまいます。巨大な工場では、このような生産管理をコンピュータを使って制御しています。ネットワークが複雑すぎて人の直感だけではもはや処理しきれないのです。同じようなことが我々の体内でも起こっており、何千種類もの酵素がお互いにバランスをとりあいながら、なにかの代謝物に過不足がないように調整しているのです。その調整のしくみに上記の「負の協同性」も加わると、おそらく制御の仕組みは予想以上にもっと複雑で精緻であることになるでしょう。実際にそうなのだと思います。すると、これまではある病気を治すのに、その病状に直接つながる(つまり、かなり最終過程の)酵素反応におもに着目していました。しかし、代謝の複雑な制御の流れがもっとしっかりと分かると、もっと上流の一見なんの関係もなさそうな(そして、他の過程には無害の)酵素反応だけを阻害してやったりすることで、病気を制御することも可能になるでしょう。
もし、人類の科学の知識がもっと進んでいたら、薬を作る時も原理的にはピンポイントにその個人にとって最適な薬を数秒で設計することができるはずです。病院に行ったら「あなたに最適な薬を設計して作りますから 30 秒ほど腰をかけて待っていてください」と言われるかもしれません。しかし、今の人類がもっている科学の知識は(特に生物学にいたっては)ほとんど何も分からず足りていないのです。「実は人類はまだほとんど自分自身のことを分かっていない」ということを知ることがたいへん重要です。
学部や大学院の講義で使ったスライドをあげています。受講生はここからダウンロードしてください。ただし、パスワードが必要です。