研究内容
【NMR解析手法の開発と高度化】
ゲノム機能発現の実体であるタンパク質が、他の生体分子(タンパク質、核酸、脂質、多糖類等)をいかに認識し、機能しているかを原子レベルで明らかにすることは、構造生物学的意義としてのみならず、その情報を創薬研究等へと応用していく上でも期待されるものである。多様でかつ複雑なタンパク質複合体に対して、水溶液中での解析が可能なNMR法は強力な解析手法になると期待されるが、NMR解析の場合、解析対象の分子量が大きな障害となっている。我々は、適切にデザインされた安定同位体標識法と新規NMR測定技術の開発により、生体高分子複合体の分子認識機構を明らかにする解析手法の開発・高度化に取り組んでいる。以下、我々が開発に携わったNMR手法について紹介する。
(1)交差飽和法による高精度な分子間相互作用界面同定
(A)交差飽和法
H. Takahashi, T. Nakanishi, K. Kami, Y. Arata, and I. Shimada, Nat. Struct. Biol., 7, 220-223 (2000)
I. Shimada, T. Ueda, M. Matsumoto, M. Sakakura, M. Osaswa, K. Takeuchi, N. Nishida, and H. Takahashi, Prog. NMR Spectrosc., 54, 123-140 (2008)
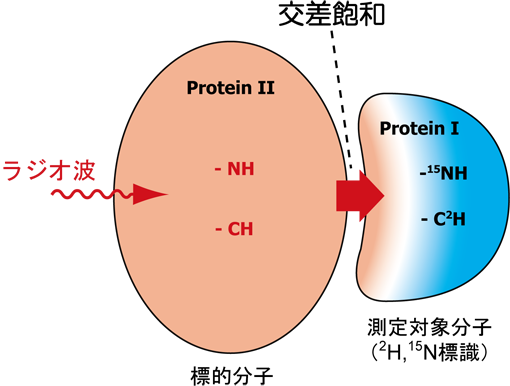
NMRによりタンパク質を舞台とする相互作用解析、特に、その相互作用部位の同定を行う際に、もっとも汎用的に利用される手法は化学シフト摂動法である。化学シフト摂動法は、シンプルな相互作用部位同定法であるが、化学シフトを変化させる要因は多岐におよぶため、複数の要因による化学シフト変化が全体として打ち消しあう可能性もあり、結合部位に存在する残基でも化学シフト変化が観測されない場合も起こり得る。また、直接の結合界面以外においても、結合により構造変化が誘起されるような部位には、化学シフト変化が引き起こされることもある。このような化学シフト摂動法によるタンパク質複合体の相互作用部位同定における曖昧さを回避するため、我々は交差飽和法の開発を行った(図1)。2Hおよび15 Nで安定同位体標識を施した測定対象分子(Protein I)に非標識の標的分子(Protein II)が結合している複合体系に対し、脂肪族プロトン領域の共鳴周波数でラジオ波を照射することで、標的分子のプロトンのみを選択的に飽和することが可能となる。特に、高分子量タンパク質複合体においては、照射によるシグナル飽和は、プロトン間の双極子−双極子相互作用に基づくスピン拡散現象により、速やかに標的分子全体の飽和を引き起こす。この標的分子の飽和現象は、分子間双極子−双極子相互作用により、複合体結合界面を通し測定対象分子へと伝播することになる。測定対象分子は重水素化されており、プロトン密度が低くスピン拡散の影響が抑制されているため、この分子間飽和移動の影響は、測定対象分子の結合界面に限定される。本実験を成功裏に実施するためには、測定対象分子のプロトン密度を低くすることが重要であり、そのため、測定溶媒の軽水/重水率を低く(10%〜20%程度)することが必要となる。分子間飽和移動現象は、測定対象分子のNMRシグナル強度の減少により容易に観測できるため、シグナル強度の減少した残基を、結合部位に存在するものとして同定することができる(図2&図3)。
(B)転移交差飽和法
T. Nakanishi, M. Miyazawa, M. Sakakura, H. Terasawa, H. Takahashi, and I. Shimada, J. Mol. Biol., 318, 245-249 (2002)
I. Shimada, T. Ueda, M. Matsumoto, M. Sakakura, M. Osaswa, K. Takeuchi, N. Nishida, and H. Takahashi, Prog. NMR Spectrosc., 54, 123-140 (2008)
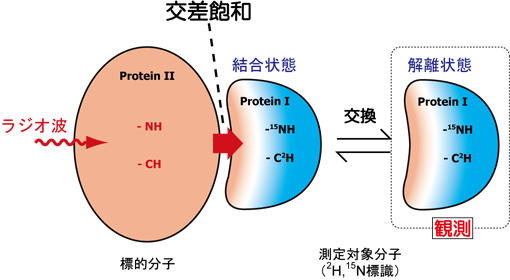
交差飽和法は、分子間プロトンの距離に依存する双極子−双極子相互作用を活用した測定法であるため、従来法(化学シフト摂動法や水素−重水素交換法など)に比べ、高精度な相互作用界面同定が行える。近年の同位体標識試料調製技術の進歩、新規NMR測定法の開発等により、従来では考えられなかった高分子量タンパク質複合体のNMR測定が可能になってきたとはいえ、依然NMR測定・解析における分子量限界があるのは事実であり、これは交差飽和法においてもあてはまるものである。そこで、我々はタンパク質複合体における交換系の概念を導入することにより、分子量限界を克服する交差飽和法の拡張を行った。図4に示すように、標的分子に対し過剰量の測定対象分子を添加した相互作用系を想定する。交差飽和による分子間の飽和移動の速度に対し、両分子間の解離速度が十分に速い場合には、結合状態で見られる交差飽和現象が解離状態の測定対象分子においても観測することが可能になる。この転移交差飽和法においては、分子間相互作用を解離状態の測定対象分子で観測することになるため、タンパク質複合体そのものの分子量がNMR観測に大きく影響を与えることはない。
転移交差飽和法への展開は、多種多様なタンパク質複合体系に対するNMR相互作用解析を可能とした。転移交差飽和法の場合、(1)複合体分子量に大きく制限されない、(2)観測対象が解離状態であるため、結合状態の測定対象分子のNMRシグナル帰属を必要としない、(3)標的分子の絶対量が少なく、(測定対象分子の数分の一から数十分の一程度)済むため、標的分子の大量調製が困難、あるいは溶解度が低い相互作用系での解析が可能となる、といった長所があるためである。巨大タンパク質複合体系、ゲル様の線維状コラーゲンとその結合タンパク質の相互作用系、脂質二重膜(リポソーム、バイセル)と結合タンパク質(ペプチド)の相互作用系、イオンチャネルと阻害タンパク質の相互作用系、といった対象においても、転移交差飽和法の適用が可能であり、相互作用界面の同定に成功している。
(C)メチル基利用交差飽和法
H. Takahashi, M. Miyazawa, Y. Ina, Y. Fukunishi, Y. Mizukoshi, H. Nakamura, and I. Shimada, J. Biomol. NMR, 34, 167-177 (2006)
I. Shimada, T. Ueda, M. Matsumoto, M. Sakakura, M. Osaswa, K. Takeuchi, N. Nishida, and H. Takahashi, Prog. NMR Spectrosc., 54, 123-140 (2008)
交差飽和法(転移交差飽和法)においては、標的分子と測定対象分子のプロトン密度が大きく異なることがポイントであり、特に高精度で相互作用界面を同定するためには、測定溶媒の軽水/重水率を低くすることが重要である。しかしながら、この条件は、通常のアミドプロトン検出によるNMR測定法(HSQCや TROSY-HSQC測定等)においては、測定感度の低下を引き起こすことにもなる。また、軽水/重水率が低い溶媒条件ではアミドプロトンの縦緩和速度が遅くなり、NMR測定の繰り返し遅延時間を長くとる必要もあることから、測定時間が長くなる傾向にある。一方、一般にタンパク質複合体において、その相互作用に直接寄与するのは、アミノ酸側鎖であることが多い。これに対し、主鎖アミドプロトンは相互作用界面からやや離れた距離に存在することになる。このため、アミドプロトン検出による交差飽和法の場合、標的タンパク質からの飽和移動の効率はそれほど高いとはいえない。我々は、側鎖メチルプロトンを利用することで、交差飽和法におけるこれらの問題点を克服することを試みた。Kayらにより提案されているメチル選択的プロトン標識法とMethyl-TROSY 法を利用することで、極めて高分子量のタンパク質複合体に対するNMR観測が可能であることが示されてきている。また、メチル基まわりの速い回転運動により、メチルプロトンの縦緩和速度は高分子量においても速いことが知られている。このメチルプロトンの緩和特性は、スピン拡散現象を軽減する効果があることが、我々のシミュレーションにより判明した。これらのメチル基の特長を活用することで、メチル基を検出プローブとする交差飽和実験=メチル基利用交差飽和法により、高分子量タンパク質複合体の相互作用界面が高感度・高精度に同定できることが明らかとなった。メチル基利用交差飽和法を実際の高分子量タンパク質複合体に適用した例を図5に示す。Ile、Leuのみをプロトン化した濃度80μMの重水素化FBとヒト抗体(免疫グロブリンG)の複合体(複合体分子量>16万5千)を対象とし、測定温度15℃という条件で交差飽和実験を行った。高分子量タンパク質複合体であるにも関わらず、Methyl-TROSY 測定により高感度なNMRシグナル検出が可能であった。抗体分子の選択的ラジオ波照射を行った結果、FBのLeu18、Ile32のメチル基由来のシグナルが有意に強度減少していることが判明したが、複合体のX線結晶構造から、これら2残基は確かに結合界面に存在していることがわかる。これらの残基と同一ヘリックス構造上に存在するが、結合界面には存在しないIle17やLeu35については、抗体分子結合に伴う顕著な化学シフト変化が見られたが、交差飽和実験におけるシグナル減少がみられないことから、メチル基利用交差飽和法により正確な結合界面同定が行えることが明らかとなった。
メチル基利用交差飽和法は、交換系を活用した転移交差飽和実験としても利用可能であることから、さらに広範な複合体系への適用、特に、高分子量・低収量・低溶解性であり、通常の構造解析の困難なタンパク質複合体系の相互作用解析において活用できる方法になると考えられる。
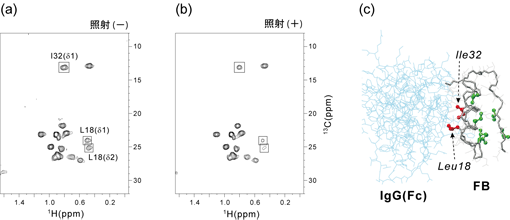
(2)標的分子結合型ペプチドの立体構造精密化のための交差相関緩和測定法の開発
H. Takahashi and I. Shimada, J. Biomol. NMR, 37, 179-185 (2007)
Y. Mizukoshi, M. Nagasu, I. Shimada, and H. Takahashi, J. Biomol. NMR, 46, 299-305 (2010)
抗Fasリガンド抗体を標的として、ファージディスプレーライブラリから得られた15残基(ライブラリ部分は10残基)のペプチドリガンド
P1: SPFARPLLSYGSGDhS
P2: LDTPVPRPPWGSGDhS
について、その標的分子結合状態の高精度立体構造決定を行った例を示す。本ペプチド群は標的分子に対し、解離定数が数100μM程度という弱い親和性を示す。
我々が独自に開発したファージ由来ペプチド調製システム(Mizukoshi et al., JBNMR (2006))を活用することで、容易に安定同位体(13C, 15 N)標識ペプチドを調製することができた。安定同位体標識ペプチドを用いることにより、NMR解析を迅速かつ精度良く行えたが、構造決定に供することが可能な転移NOE(TrNOE)の数は 66(P1)/51(P2)個であり、これは、NMRにより球状タンパク質の立体構造決定を行う際に必要とされるNOE数(1残基平均で10〜15以上)に比べ著しく少ないものである。このTrNOE情報のみにより標的分子結合状態におけるペプチドの立体構造計算を行ったのが図6(a)(c)である。図からわかるように、本ペプチドは伸びた(extended)状態で標的分子に結合していることがわかったが、決定された立体構造の収束が良くないため、主鎖のコンフォメーション、および側鎖の配向を議論できる質の立体構造ではない。立体構造の収束が悪い原因としては、(1)絶対的なNOE(距離)情報の不足、(2)通常の可溶タンパク質等の解析において利用可能な、他の構造パラメーター(スピン結合定数や化学シフトインデックスに基づく二面角情報等)の情報が得られないこと、などが考えられる。
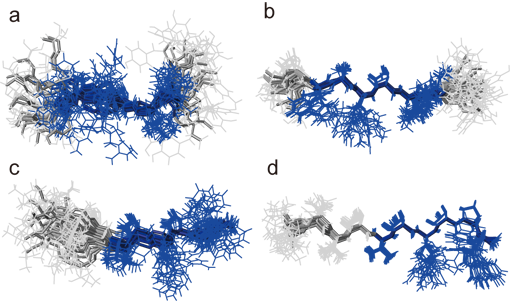
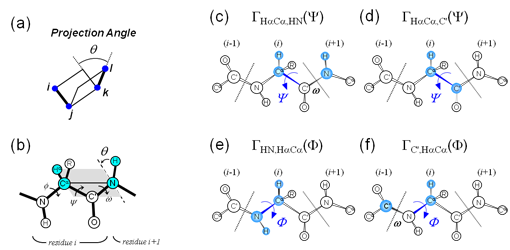
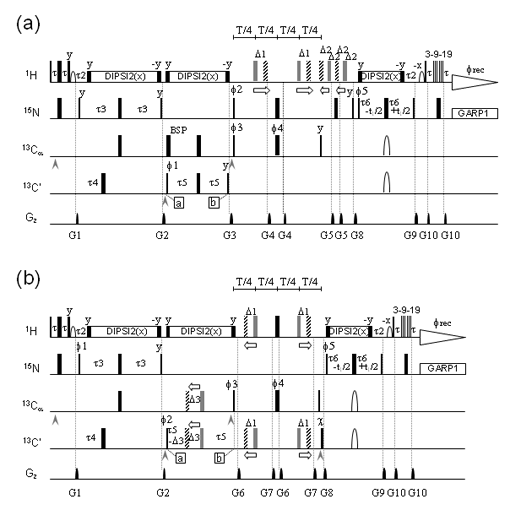
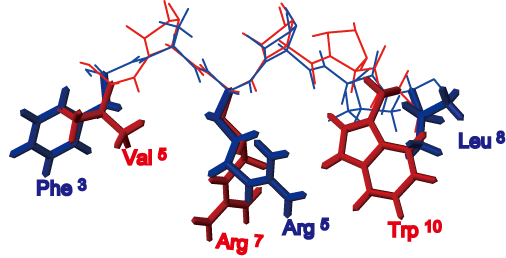
そこで、主鎖二面角情報を得るため、転移交差相関緩和(TrCCR)実験の適用を試みた(図7(a)(b))。これまでに、主鎖二面角のうちΨ角の拘束条件(図7(c)(d))を得るための2種類のCCR測定法はすでに提案されていたが、Φ角を簡便かつ直接的に求める方法は存在していなかった。我々は、 intraHNCA測定法のコヒーレンスを活用することにより、Φ角に関わる交差相関緩和(図7(e)(f))を簡便に求められる測定方法を開発した(図8)。本手法を適用することで、主鎖二面角に関し、合計15(P1)/8(P2)個の拘束条件が得られた。TrNOEによる距離情報と組み合わせ構造計算した結果が、図6(b)(d)である。図6(a)(c)のTrNOE情報のみによる構造に比べ、得られた構造の収束が向上し、側鎖の主鎖に対する配向が判別できるようになったことがわかる。これら2種類のペプチドについてアラニン変異実験から、Phe3、Arg5、Leu8(P1)、およびVal5、 Arg7、Trp10(P2)の3残基が、標的タンパク質(抗Fasリガンド抗体)との結合に関与していることが推察されていた。両ペプチドは見かけ上アミノ酸配列の相同性がないように見えるが、その主鎖構造はよく重なり(RMSD= 1.06Å)、結合に重要な側鎖が同一方向に配向し標的分子との結合に寄与していると考えられる(図9)。本手法により得られる高精度の結合型ペプチド立体構造情報は、ペプチドの構造活性相関を理解する上で極めて重要であり、ペプチドの高機能化や低分子化のための有用な指針となっていくことが期待される。
(3)NMRシグナル帰属フリーの相互作用解析法
Y. Kodama, M. L. Reese, N. Shimba, K. Ono, E. Kanamori, V. Dötsch, S. Noguchi, Y. Fukunishi, E. Suzuki, I. Shimada and H. Takahashi, J. Struct. Biol., 174, 434-442 (2011)
UNDER CONSTRUCTION
(4)DIRECTIONアプローチによるリガンドエピトープマッピング
Y. Mizukoshi, A. Abe, T. Takizawa, H. Hanzawa, Y. Fukunishi, I. Shimada, and H. Takahashi, Angew. Chem. Int. Ed., 51, 1362-1365 (2012)
Y. Fukunishi, Y. Mizukoshi, K. Takeuchi, I. Shimada, H. Takahashi, and H. Nakamura, J. Mol. Graph. Mod., 31, 20-27 (2011)
UNDER CONSTRUCTION
ゲノム機能発現の実体であるタンパク質が、他の生体分子(タンパク質、核酸、脂質、多糖類等)をいかに認識し、機能しているかを原子レベルで明らかにすることは、構造生物学的意義としてのみならず、その情報を創薬研究等へと応用していく上でも期待されるものである。多様でかつ複雑なタンパク質複合体に対して、水溶液中での解析が可能なNMR法は強力な解析手法になると期待されるが、NMR解析の場合、解析対象の分子量が大きな障害となっている。我々は、適切にデザインされた安定同位体標識法と新規NMR測定技術の開発により、生体高分子複合体の分子認識機構を明らかにする解析手法の開発・高度化に取り組んでいる。以下、我々が開発に携わったNMR手法について紹介する。
(1)交差飽和法による高精度な分子間相互作用界面同定
(A)交差飽和法
H. Takahashi, T. Nakanishi, K. Kami, Y. Arata, and I. Shimada, Nat. Struct. Biol., 7, 220-223 (2000)
I. Shimada, T. Ueda, M. Matsumoto, M. Sakakura, M. Osaswa, K. Takeuchi, N. Nishida, and H. Takahashi, Prog. NMR Spectrosc., 54, 123-140 (2008)
NMRによりタンパク質を舞台とする相互作用解析、特に、その相互作用部位の同定を行う際に、もっとも汎用的に利用される手法は化学シフト摂動法である。化学シフト摂動法は、シンプルな相互作用部位同定法であるが、化学シフトを変化させる要因は多岐におよぶため、複数の要因による化学シフト変化が全体として打ち消しあう可能性もあり、結合部位に存在する残基でも化学シフト変化が観測されない場合も起こり得る。また、直接の結合界面以外においても、結合により構造変化が誘起されるような部位には、化学シフト変化が引き起こされることもある。このような化学シフト摂動法によるタンパク質複合体の相互作用部位同定における曖昧さを回避するため、我々は交差飽和法の開発を行った(図1)。2Hおよび15 Nで安定同位体標識を施した測定対象分子(Protein I)に非標識の標的分子(Protein II)が結合している複合体系に対し、脂肪族プロトン領域の共鳴周波数でラジオ波を照射することで、標的分子のプロトンのみを選択的に飽和することが可能となる。特に、高分子量タンパク質複合体においては、照射によるシグナル飽和は、プロトン間の双極子−双極子相互作用に基づくスピン拡散現象により、速やかに標的分子全体の飽和を引き起こす。この標的分子の飽和現象は、分子間双極子−双極子相互作用により、複合体結合界面を通し測定対象分子へと伝播することになる。測定対象分子は重水素化されており、プロトン密度が低くスピン拡散の影響が抑制されているため、この分子間飽和移動の影響は、測定対象分子の結合界面に限定される。本実験を成功裏に実施するためには、測定対象分子のプロトン密度を低くすることが重要であり、そのため、測定溶媒の軽水/重水率を低く(10%〜20%程度)することが必要となる。分子間飽和移動現象は、測定対象分子のNMRシグナル強度の減少により容易に観測できるため、シグナル強度の減少した残基を、結合部位に存在するものとして同定することができる(図2&図3)。

図1:交差飽和法の概念図

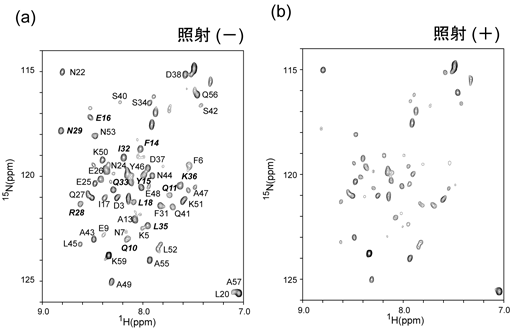
図2:交差飽和実験例
[2H, 15
N]標識したFBと抗体
Fcフラグメントの複合体を測定試料とした(複合体分子量約64K)。(a)ラジオ波非照射のTROSY-HSQCスペクトル、(b)標的分子(Fc)を照射したスペクトル

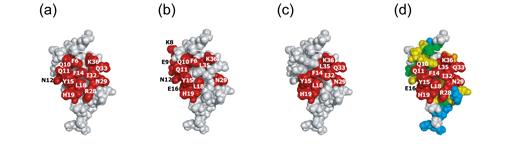
図3:異なるNMR手法で推定されたFBの抗体(Fc)結合部位(赤色)の比較
(a)X線結晶構造から得られた抗体との接触面、(b)化学シフト摂動法から推定される結合部位、(c)水素−重水素交換実験により推定される結合部位、
(d)交差飽和法により推定される結合部位。(B)転移交差飽和法
T. Nakanishi, M. Miyazawa, M. Sakakura, H. Terasawa, H. Takahashi, and I. Shimada, J. Mol. Biol., 318, 245-249 (2002)
I. Shimada, T. Ueda, M. Matsumoto, M. Sakakura, M. Osaswa, K. Takeuchi, N. Nishida, and H. Takahashi, Prog. NMR Spectrosc., 54, 123-140 (2008)
交差飽和法は、分子間プロトンの距離に依存する双極子−双極子相互作用を活用した測定法であるため、従来法(化学シフト摂動法や水素−重水素交換法など)に比べ、高精度な相互作用界面同定が行える。近年の同位体標識試料調製技術の進歩、新規NMR測定法の開発等により、従来では考えられなかった高分子量タンパク質複合体のNMR測定が可能になってきたとはいえ、依然NMR測定・解析における分子量限界があるのは事実であり、これは交差飽和法においてもあてはまるものである。そこで、我々はタンパク質複合体における交換系の概念を導入することにより、分子量限界を克服する交差飽和法の拡張を行った。図4に示すように、標的分子に対し過剰量の測定対象分子を添加した相互作用系を想定する。交差飽和による分子間の飽和移動の速度に対し、両分子間の解離速度が十分に速い場合には、結合状態で見られる交差飽和現象が解離状態の測定対象分子においても観測することが可能になる。この転移交差飽和法においては、分子間相互作用を解離状態の測定対象分子で観測することになるため、タンパク質複合体そのものの分子量がNMR観測に大きく影響を与えることはない。
転移交差飽和法への展開は、多種多様なタンパク質複合体系に対するNMR相互作用解析を可能とした。転移交差飽和法の場合、(1)複合体分子量に大きく制限されない、(2)観測対象が解離状態であるため、結合状態の測定対象分子のNMRシグナル帰属を必要としない、(3)標的分子の絶対量が少なく、(測定対象分子の数分の一から数十分の一程度)済むため、標的分子の大量調製が困難、あるいは溶解度が低い相互作用系での解析が可能となる、といった長所があるためである。巨大タンパク質複合体系、ゲル様の線維状コラーゲンとその結合タンパク質の相互作用系、脂質二重膜(リポソーム、バイセル)と結合タンパク質(ペプチド)の相互作用系、イオンチャネルと阻害タンパク質の相互作用系、といった対象においても、転移交差飽和法の適用が可能であり、相互作用界面の同定に成功している。

図4:転移交差飽和法の概念図
(C)メチル基利用交差飽和法
H. Takahashi, M. Miyazawa, Y. Ina, Y. Fukunishi, Y. Mizukoshi, H. Nakamura, and I. Shimada, J. Biomol. NMR, 34, 167-177 (2006)
I. Shimada, T. Ueda, M. Matsumoto, M. Sakakura, M. Osaswa, K. Takeuchi, N. Nishida, and H. Takahashi, Prog. NMR Spectrosc., 54, 123-140 (2008)
交差飽和法(転移交差飽和法)においては、標的分子と測定対象分子のプロトン密度が大きく異なることがポイントであり、特に高精度で相互作用界面を同定するためには、測定溶媒の軽水/重水率を低くすることが重要である。しかしながら、この条件は、通常のアミドプロトン検出によるNMR測定法(HSQCや TROSY-HSQC測定等)においては、測定感度の低下を引き起こすことにもなる。また、軽水/重水率が低い溶媒条件ではアミドプロトンの縦緩和速度が遅くなり、NMR測定の繰り返し遅延時間を長くとる必要もあることから、測定時間が長くなる傾向にある。一方、一般にタンパク質複合体において、その相互作用に直接寄与するのは、アミノ酸側鎖であることが多い。これに対し、主鎖アミドプロトンは相互作用界面からやや離れた距離に存在することになる。このため、アミドプロトン検出による交差飽和法の場合、標的タンパク質からの飽和移動の効率はそれほど高いとはいえない。我々は、側鎖メチルプロトンを利用することで、交差飽和法におけるこれらの問題点を克服することを試みた。Kayらにより提案されているメチル選択的プロトン標識法とMethyl-TROSY 法を利用することで、極めて高分子量のタンパク質複合体に対するNMR観測が可能であることが示されてきている。また、メチル基まわりの速い回転運動により、メチルプロトンの縦緩和速度は高分子量においても速いことが知られている。このメチルプロトンの緩和特性は、スピン拡散現象を軽減する効果があることが、我々のシミュレーションにより判明した。これらのメチル基の特長を活用することで、メチル基を検出プローブとする交差飽和実験=メチル基利用交差飽和法により、高分子量タンパク質複合体の相互作用界面が高感度・高精度に同定できることが明らかとなった。メチル基利用交差飽和法を実際の高分子量タンパク質複合体に適用した例を図5に示す。Ile、Leuのみをプロトン化した濃度80μMの重水素化FBとヒト抗体(免疫グロブリンG)の複合体(複合体分子量>16万5千)を対象とし、測定温度15℃という条件で交差飽和実験を行った。高分子量タンパク質複合体であるにも関わらず、Methyl-TROSY 測定により高感度なNMRシグナル検出が可能であった。抗体分子の選択的ラジオ波照射を行った結果、FBのLeu18、Ile32のメチル基由来のシグナルが有意に強度減少していることが判明したが、複合体のX線結晶構造から、これら2残基は確かに結合界面に存在していることがわかる。これらの残基と同一ヘリックス構造上に存在するが、結合界面には存在しないIle17やLeu35については、抗体分子結合に伴う顕著な化学シフト変化が見られたが、交差飽和実験におけるシグナル減少がみられないことから、メチル基利用交差飽和法により正確な結合界面同定が行えることが明らかとなった。
メチル基利用交差飽和法は、交換系を活用した転移交差飽和実験としても利用可能であることから、さらに広範な複合体系への適用、特に、高分子量・低収量・低溶解性であり、通常の構造解析の困難なタンパク質複合体系の相互作用解析において活用できる方法になると考えられる。
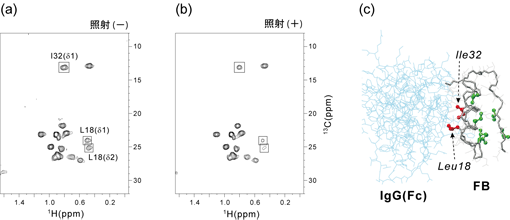
図5:メチル基利用交差飽和実験
メチル選択的プロトン化標識したFBと抗体の複合体(複合体分子量>165K)を測定試料とした。(a)ラジオ波非照射のMethyl-TROSYスペクトル。(b)標的分子(抗体)を照射したスペクトル。ラジオ波照射によってシグナル強度が減少した残基由来のメチル基を□で示している。(c)抗体(Fc)-FB複合体のX線結晶構造(PDB ID: 1FC2)。(2)標的分子結合型ペプチドの立体構造精密化のための交差相関緩和測定法の開発
H. Takahashi and I. Shimada, J. Biomol. NMR, 37, 179-185 (2007)
Y. Mizukoshi, M. Nagasu, I. Shimada, and H. Takahashi, J. Biomol. NMR, 46, 299-305 (2010)
抗Fasリガンド抗体を標的として、ファージディスプレーライブラリから得られた15残基(ライブラリ部分は10残基)のペプチドリガンド
P1: SPFARPLLSYGSGDhS
P2: LDTPVPRPPWGSGDhS
について、その標的分子結合状態の高精度立体構造決定を行った例を示す。本ペプチド群は標的分子に対し、解離定数が数100μM程度という弱い親和性を示す。
我々が独自に開発したファージ由来ペプチド調製システム(Mizukoshi et al., JBNMR (2006))を活用することで、容易に安定同位体(13C, 15 N)標識ペプチドを調製することができた。安定同位体標識ペプチドを用いることにより、NMR解析を迅速かつ精度良く行えたが、構造決定に供することが可能な転移NOE(TrNOE)の数は 66(P1)/51(P2)個であり、これは、NMRにより球状タンパク質の立体構造決定を行う際に必要とされるNOE数(1残基平均で10〜15以上)に比べ著しく少ないものである。このTrNOE情報のみにより標的分子結合状態におけるペプチドの立体構造計算を行ったのが図6(a)(c)である。図からわかるように、本ペプチドは伸びた(extended)状態で標的分子に結合していることがわかったが、決定された立体構造の収束が良くないため、主鎖のコンフォメーション、および側鎖の配向を議論できる質の立体構造ではない。立体構造の収束が悪い原因としては、(1)絶対的なNOE(距離)情報の不足、(2)通常の可溶タンパク質等の解析において利用可能な、他の構造パラメーター(スピン結合定数や化学シフトインデックスに基づく二面角情報等)の情報が得られないこと、などが考えられる。
そこで、主鎖二面角情報を得るため、転移交差相関緩和(TrCCR)実験の適用を試みた(図7(a)(b))。これまでに、主鎖二面角のうちΨ角の拘束条件(図7(c)(d))を得るための2種類のCCR測定法はすでに提案されていたが、Φ角を簡便かつ直接的に求める方法は存在していなかった。我々は、 intraHNCA測定法のコヒーレンスを活用することにより、Φ角に関わる交差相関緩和(図7(e)(f))を簡便に求められる測定方法を開発した(図8)。本手法を適用することで、主鎖二面角に関し、合計15(P1)/8(P2)個の拘束条件が得られた。TrNOEによる距離情報と組み合わせ構造計算した結果が、図6(b)(d)である。図6(a)(c)のTrNOE情報のみによる構造に比べ、得られた構造の収束が向上し、側鎖の主鎖に対する配向が判別できるようになったことがわかる。これら2種類のペプチドについてアラニン変異実験から、Phe3、Arg5、Leu8(P1)、およびVal5、 Arg7、Trp10(P2)の3残基が、標的タンパク質(抗Fasリガンド抗体)との結合に関与していることが推察されていた。両ペプチドは見かけ上アミノ酸配列の相同性がないように見えるが、その主鎖構造はよく重なり(RMSD= 1.06Å)、結合に重要な側鎖が同一方向に配向し標的分子との結合に寄与していると考えられる(図9)。本手法により得られる高精度の結合型ペプチド立体構造情報は、ペプチドの構造活性相関を理解する上で極めて重要であり、ペプチドの高機能化や低分子化のための有用な指針となっていくことが期待される。

図6:NMR情報をもとに決定した抗体結合状態のペプチドの立体構造
(a)TrNOE情報のみにより決定したP1ペプチドの立体構造、(b)TrNOEとTrCCR情報により決定したP1ペプチドの立体構造、(c)
TrNOE情報のみにより決定したP2ペプチドの立体構造、(d)TrNOEとTrCCR情報により決定したP2ペプチドの立体構造。
図7:(a),(b)ペプチド主鎖二面角と双極子-双極子ペア間の
projection angle、(c)-(f) ペプチド主鎖二面角と各交差相関緩和との関係。

図8:主鎖二面角Φを求めるパルスシークエンス

図9:P1とP2の平均構造の重ね合わせ図
(3)NMRシグナル帰属フリーの相互作用解析法
Y. Kodama, M. L. Reese, N. Shimba, K. Ono, E. Kanamori, V. Dötsch, S. Noguchi, Y. Fukunishi, E. Suzuki, I. Shimada and H. Takahashi, J. Struct. Biol., 174, 434-442 (2011)
UNDER CONSTRUCTION
(4)DIRECTIONアプローチによるリガンドエピトープマッピング
Y. Mizukoshi, A. Abe, T. Takizawa, H. Hanzawa, Y. Fukunishi, I. Shimada, and H. Takahashi, Angew. Chem. Int. Ed., 51, 1362-1365 (2012)
Y. Fukunishi, Y. Mizukoshi, K. Takeuchi, I. Shimada, H. Takahashi, and H. Nakamura, J. Mol. Graph. Mod., 31, 20-27 (2011)
UNDER CONSTRUCTION